承認・届出等
販売名
ムコアップ
商品コード(JAN)
4573346600020
添付文書管理コード
21800BZZ10124000_A_01
承認番号
21800BZZ10124000
承認年月
平成18年10月19日
一般的名称
一般的名称
71028000
内視鏡用粘膜下注入材
**警告使用方法1.
本品を血管内・皮内・皮下・筋肉内に注射しないこと。[本品は医療機器の粘膜下注入材であり、医薬品の注射剤ではない。] 2.
本品は、緊急時に十分に対処できる医療機関において、内視鏡的粘膜切除術及び内視鏡的粘膜下層剥離術について十分な経験を持つ医師が使用すること。
|
禁忌・禁止適用対象(患者)本品の成分に対し過敏症の既往歴のある患者
再使用禁止
|
形状・構造及び原理等
組成
添加物
性状
pH
浸透圧比
形状
[主成分に関する理化学的知見]
1バイアル20mL中に日局 精製ヒアルロン酸ナトリウム80mgを含有する。
添加物
塩化ナトリウム
リン酸二水素ナトリウム
リン酸水素ナトリウム水和物
リン酸二水素ナトリウム
リン酸水素ナトリウム水和物
性状
無色澄明のわずかに粘稠な液
pH
7.0〜8.0
浸透圧比
0.9〜1.2(生理食塩液に対する比)
形状

[主成分に関する理化学的知見]
一般名:
分子式:
分子量:
構造式:
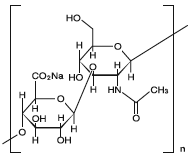
性状:
精製ヒアルロン酸ナトリウム
分子式:
(C14H20NNaO11)n
分子量:
平均分子量50万〜120万
構造式:

性状:
本品は白色の粉末、粒又は繊維状の塊である。本品は水にやや溶けにくく、エタノール(99.5)にほとんど溶けない。
本品は吸湿性である。
本品は吸湿性である。
本品は、ヒアルロン酸ナトリウム溶液の特性である粘弾性により粘膜下に滞留し、粘膜層と筋層との間を大きく解離させる。その結果として、内視鏡的粘膜切除術及び内視鏡的粘膜下層剥離術において粘膜層を切除又は剥離する際に、病変部位(粘膜層)の隆起を形成・維持する。
使用目的又は効果
内視鏡的粘膜切除術及び内視鏡的粘膜下層剥離術における食道、胃及び大腸腫瘍部位の粘膜隆起形成・維持
使用方法等
1.
用量本品の適応に際しては、病変の部位や大きさ等を考慮し、注入量を決定すること。
2.
使用方法標準的な使用方法を下記に示す。なお、臨床手技の詳細については、それぞれの専門の立場から適切に判断すること。
(1)
バイアルのキャップ部を取り外し、針刺部をアルコール消毒する。
(2)
必要に応じて通気針を使用し、必要量を注射筒に吸い取り、内視鏡用注射針を接続する。
(3)
十分な粘膜隆起が得られるまで、本品を粘膜下層に注入する。
(4)
常法に従って、内視鏡的粘膜切除術又は内視鏡的粘膜下層剥離術を施行する。
3.
使用方法等に関連する使用上の注意
(1)
本品は、食道、胃及び大腸粘膜下層に注入するので、無菌的操作のもとに使用すること。
(2)
適応となる腫瘍の内視鏡的計測による最大径については学会ガイドライン等に基づくこと(内視鏡計測による最大径20mmを超える腫瘍に使用した成績に関しては、「臨床成績」の「1.(4)使用成績調査」の項を参照)。
(3)
本品を粘膜下層に確実に注入したにもかかわらず粘膜隆起が認められない場合には内視鏡的粘膜切除術又は内視鏡的粘膜下層剥離術を中止すること。[腫瘍が粘膜下まで達している可能性が想定される。]
(4)
本品は、粘稠な液体のため、注射筒は内径の小さい5mL程度のもの、内視鏡用注射針は23G程度のものを用いて注入すること。なお、注射筒と内視鏡用注射針は、ルアーロック式接続を行うことが望ましい。
(5)
本品に破損、亀裂等の不良が認められた場合は使用しないこと。
(6)
本品の開封後の使用は1回限りとすること。残液は他の患者に使用することなく容器とともに廃棄すること。
使用上の注意
使用注意
(次の患者には慎重に適用すること)
1.
出血傾向を有する患者[有害事象として術中出血、処置後出血が報告されている。]
2.
本品の成分以外の他の薬剤に対して過敏症の既往歴のある患者
重要な基本的注意
1.
術前に患者の全身の健康状態を診察し、内視鏡的粘膜切除術又は内視鏡的粘膜下層剥離術に耐え得る状態かどうかを確認すること。
2.
過敏症を予測するため十分な問診を行うこと(「禁忌・禁止」の項及び「不具合・有害事象」を参照)。
3.
術中出血及び処置後出血が報告されているため、術後の十分な経過観察を行うこと。
相互作用
(他の医薬品・医療機器等との併用に関すること)
併用注意
(併用に注意すること)
1.
エピネフリン液及びインジゴカルミン液を本品に混和した場合、混和後5時間を超える安定性は確認していない。また、その他の着色剤は本品に混和することにより配合変化する可能性がある。
2.
本品は、殺菌消毒剤である塩化ベンザルコニウム等の第4級アンモニウム塩及びクロルヘキシジンにより沈殿を生じることがあるので、本品が接触する可能性のある機器に対してこれらの殺菌消毒剤が使用される場合は、滅菌水でよく洗い流した後使用すること。
3.
本品は、エタノールにより沈殿を生じることがあるので、本品を使用した内視鏡用注射針を用いてエタノールの注入を行わないこと。
不具合・有害事象
胃及び大腸:
食道:
胃及び大腸を適応部位とした臨床試験において、胃粘膜内腫瘍患者70症例中1症例(1件)、大腸粘膜内腫瘍患者41症例中2症例(2件)に処置後出血の副作用が認められた。大腸粘膜内腫瘍患者の1症例(1件)は重篤(治療のため入院)であった。
また、市販後の使用成績調査における総症例856症例中16症例16件(1.9%)に副作用(本品との関連性不明)が認められた。主なものは処置後出血11件(1.3%)[うち重篤6件]で、穿孔3件(0.4%)[うち重篤2件]、不安定狭心症(重篤)及び背部痛(重篤)が各1件(0.1%)であった。
また、市販後の使用成績調査における総症例856症例中16症例16件(1.9%)に副作用(本品との関連性不明)が認められた。主なものは処置後出血11件(1.3%)[うち重篤6件]で、穿孔3件(0.4%)[うち重篤2件]、不安定狭心症(重篤)及び背部痛(重篤)が各1件(0.1%)であった。
食道:
評価対象とした臨床報告19報754例で副作用は報告されなかった。
重大な有害事象
処置後出血[頻度1.4%(14/967例)]:
処置後出血があらわれることがあるので、十分に観察を行い、症状が認められた場合は適切に処置すること。
本品と同一成分の注射剤の投与によりショック症状(頻度不明注))があらわれることがあるので、観察を十分に行い、異常が認められた場合には使用を中止し、適切な処置を行うこと。
その他の有害事象
本品と同一成分の注射剤の投与により過敏症として、蕁麻疹等の発疹、そう痒感、浮腫(顔面、眼瞼等)、顔面発赤があらわれることがあるので、発現した場合は使用を中止し、適切な処置を行うこと。
| 分類\頻度 | 0.1%未満 | 頻度不明注) |
| 過敏症 | 蕁麻疹等の発疹、そう痒感 | 浮腫(顔面、眼瞼等)、顔面発赤 |
高齢者への適用
一般に高齢者では生理機能が低下しているので注意すること。
妊婦、産婦、授乳婦及び小児等への適用
妊婦又は妊娠している可能性のある婦人及び授乳婦には、治療上の有益性が危険性を上回ると判断される場合にのみ使用すること。[妊娠中、授乳中の使用に関する安全性は確立していない。]また、小児に対する安全性は確立していない。
臨床成績
1.
胃及び大腸
(1)
胃粘膜内腫瘍1)
内視鏡的に胃粘膜内に限局した腫瘍性病変を有し、その治療方法として内視鏡的粘膜切除術が適応とされる患者に対して、生理食塩液を用いた内視鏡的粘膜切除術を対照群として、内視鏡的粘膜切除術におけるムコアップの手術補助能を評価した。結果、手術補助能及び手術補助能の有効率においてムコアップ群と対照群に有意差が認められた。
| 項目 | ムコアップ群 (N=62)*1 | 対照群 (N=60)*1 | p値 | |
| 手術補助能*2 | 著効 | 55(88.7%) | 24(40.0%) | p<0.001*4 |
| 有効 | 1(1.6%) | 10(16.7%) | ||
| やや有効 | 2(3.2%) | 22(36.7%) | ||
| 無効 | 4(6.5%) | 4(6.7%) | ||
| 手術補助能の有効率*3 | 56(90.3%) | 34(56.7%) | p<0.001*5 | |
(2)
大腸粘膜内腫瘍2)
内視鏡的に大腸粘膜内に限局した腫瘍性病変を有し、その治療方法として内視鏡的粘膜切除術が適応とされる患者に対して、ムコアップの手術補助能を評価した。結果、手術補助能の有効率は81.6%であった。
| 項目 | ムコアップ群 (N=38)*6 |
|
| 手術補助能*2 | 著効 | 31(81.6%) |
| 有効 | 0(0%) | |
| やや有効 | 0(0%) | |
| 無効 | 7(18.4%) | |
| 手術補助能の有効率*3 | 31(81.6%) | |
(3)
胃及び大腸粘膜内腫瘍における使用量治験段階における腫瘍径20 mm以下の治療における本品の使用量は以下のとおりであった。尚、30 mLを超える使用例数は少なかった。
*1:有効性評価対象症例数は、治験用具が使用された140症例中、ムコアップ群62症例、対照群60症例であった
*2:一括完全切除が得られ、追加粘膜下注入回数が0回のものを「著効」、1回のものを「有効」、2回以上のものを「やや有効」とした。一括完全切除が得られなかったものを「無効」とした
*3:手術補助能における「有効」以上の比率
*4:Wilcoxonの2標本検定
*5:Fisherの直接確率法
*6:有効性評価対象症例数は、治験用具が使用された41症例中、38症例であった
| 使用量 | ムコアップ群 | |
| 胃 (N=61) | 〜10 mL | 17(27.9%) |
| 〜20 mL | 34(55.7%) | |
| 〜30 mL | 9(14.8%) | |
| >30 mL | 1(1.6%) | |
| 大腸 (N=38) | 〜10 mL | 32(84.2%) |
| 〜20 mL | 5(13.2%) | |
| 〜30 mL | 1(2.6%) | |
| >30 mL | 0(0%) | |
*2:一括完全切除が得られ、追加粘膜下注入回数が0回のものを「著効」、1回のものを「有効」、2回以上のものを「やや有効」とした。一括完全切除が得られなかったものを「無効」とした
*3:手術補助能における「有効」以上の比率
*4:Wilcoxonの2標本検定
*5:Fisherの直接確率法
*6:有効性評価対象症例数は、治験用具が使用された41症例中、38症例であった
(4)
使用成績調査3)
再審査期間中の術前中央登録方式による使用成績調査では、全国の医療機関から評価対象症例として856例(胃病変例482例、大腸病変例374例)を収集した。安全性については、856症例のうち不具合が発現したのは16症例(1.9%)であった(前記「不具合・有害事象」の項を参照)。医師の判断による安全性評価では、「安全性に問題なし」が99.5%(852/856例)、「安全性に問題あり」が0%、「判定不能」が0.5%(4/856例)であった。有効性については、「一括完全切除の判定」及び「粘膜切除の容易性」で評価した。「一括完全切除が得られた」症例は、胃病変例で93.6%(451/482例)、大腸病変例で78.6%(294/374例)であった。「粘膜切除の容易性」については、「極めて容易であった」「容易であった」「普通」「困難であった」の4段階評価で、「容易であった」以上が胃病変例で80.7%(389/482例)、大腸病変例で80.2%(300/374例)であった。
本品が使用された腫瘍の大きさ(内視鏡計測上、長径)については以下のとおりであった。20 mm以下の症例が66.8%(572/856例)、20 mmを超えた症例は33.2%(284/856例)であった。20 mmを超えた症例のうち6例に不具合が発現し、3例(処置後出血)が重篤であった。
本品の使用量については以下のとおりであった。承認時の臨床試験では30 mLを超える症例数は少なかったが、当該調査では30 mLを超えた症例が23.2%(199/856例)あった。30 mLを超えた症例のうち胃病変例の4例に不具合が発現し、3例(処置後出血、穿孔、急性腰痛症)が重篤であった。なお、最大使用量は180 mLであったが、不具合の発現はなかった。
なお、使用成績調査内容については、文献4)がでている。
本品が使用された腫瘍の大きさ(内視鏡計測上、長径)については以下のとおりであった。20 mm以下の症例が66.8%(572/856例)、20 mmを超えた症例は33.2%(284/856例)であった。20 mmを超えた症例のうち6例に不具合が発現し、3例(処置後出血)が重篤であった。
| 病変の大きさ(長径) 内視鏡計測上 | 症例数(%) | 不具合 症例数(%) | 検定結果 | 重篤 症例数 |
| ≦5 mm 5 mm< ≦10 mm 10 mm< ≦15 mm 15 mm< ≦20 mm 20 mm< ≦30 mm 30 mm< ≦40 mm 40 mm< ≦50 mm 50 mm< ≦60 mm 60 mm< | 45(5.3) 206(24.1) 173(20.2) 148(17.3) 164(19.2) 80(9.3) 18(2.1) 11(1.3) 11(1.3) | 0(0.0) 2(1.0) 5(2.9) 3(2.0) 4(2.4) 1(1.3) 1(5.6) 0(0.0) 0(0.0) | p=0.379 | − 2 3 2 2 1 0 − − |
| 合計 | 856(100.0) | 16(1.9) | 10 |
本品の使用量については以下のとおりであった。承認時の臨床試験では30 mLを超える症例数は少なかったが、当該調査では30 mLを超えた症例が23.2%(199/856例)あった。30 mLを超えた症例のうち胃病変例の4例に不具合が発現し、3例(処置後出血、穿孔、急性腰痛症)が重篤であった。なお、最大使用量は180 mLであったが、不具合の発現はなかった。
| 本品の使用量 | 症例数(%) | 不具合 症例数(%) | 検定結果 | 重篤 症例数 |
| ≦10 mL 10 mL< ≦20 mL 20 mL< ≦30 mL 30 mL< ≦40 mL 40 mL< ≦50 mL 50 mL< ≦60 mL 60 mL< | 307(35.9) 284(33.2) 66(7.7) 85(9.9) 32(3.7) 31(3.6) 51(6.0) | 7(2.3) 4(1.4) 1(1.5) 2(2.4) 1(3.1) 1(3.2) 0(0.0) | p=0.665 | 5 2 0 2 1 0 − |
| 合計 | 856(100.0) | 16(1.9) | 10 |
なお、使用成績調査内容については、文献4)がでている。
2.
食道5)
公表された食道粘膜内腫瘍に対して行われた内視鏡的粘膜切除術、内視鏡的粘膜下層剥離術の臨床報告について安全性・有効性評価を行った。
有効性評価に用いた臨床報告15報において、局注液にヒアルロン酸ナトリウム溶液を用いた内視鏡的粘膜下層剥離術の報告のうち一括切除率100%が10報、同97%が3報、同94%が2報であり高い一括切除率を示した。また最大切除病変径は94 mmであった。
局注液に生理食塩液を使用した内視鏡的粘膜下層剥離術の報告3報のうち一括切除率100%が2報、他は93.3%であったが、最大切除病変径は70 mmであった。
安全性評価に用いた臨床報告19報754例では副作用はみられなかったが、主な有害事象は、食道狭窄53件(7.0%)、穿孔24件(3.2%)、出血10件(1.3%)であった。
有効性評価に用いた臨床報告15報において、局注液にヒアルロン酸ナトリウム溶液を用いた内視鏡的粘膜下層剥離術の報告のうち一括切除率100%が10報、同97%が3報、同94%が2報であり高い一括切除率を示した。また最大切除病変径は94 mmであった。
局注液に生理食塩液を使用した内視鏡的粘膜下層剥離術の報告3報のうち一括切除率100%が2報、他は93.3%であったが、最大切除病変径は70 mmであった。
安全性評価に用いた臨床報告19報754例では副作用はみられなかったが、主な有害事象は、食道狭窄53件(7.0%)、穿孔24件(3.2%)、出血10件(1.3%)であった。
保管方法及び有効期間等
保管方法
室温保存(1〜30℃)
凍結を避けること
使用期限
製造日から3年6箇月(外箱及びラベルに表示)
[自社データによる]
[自社データによる]
包装
0.4% 20 mL:10バイアル
主要文献及び文献請求先
主要文献
1.
生化学工業社内資料
2.
生化学工業社内資料
3.
生化学工業社内資料
4.
松木暢彦他:薬理と治療, 40, 381〜403(2012)
5.
生化学工業社内資料
**,*文献請求先
ボストン・サイエンティフィック ジャパン株式会社
〒164-0001 東京都中野区中野四丁目10番2号
電話:03-6853-0940
製造販売業者及び製造業者の氏名又は名称等
氏名又は名称
[製造販売元]
生化学工業株式会社
第一種医療機器製造販売業
電話番号
03-5220-8950
その他の安全性情報
備考
*[発売元]
ボストン・サイエンティフィック ジャパン株式会社
電話:03-6853-1000
電話:03-6853-1000