承認・届出等
販売名
Expedium コバルトクロム ロッド5.5
添付文書管理コード
22400BZX00237000_A_01
承認番号
22400BZX00237000
承認・認証年月等
平成24年7月
一般的名称
一般的名称
37272003
脊椎内固定器具
警告(記載なし)
|
禁忌・禁止1.次の患者には使用しないこと
(1)活動性全身感染症または埋植予定部位に感染がある患者[感染の長期化およびこれによる遷延癒合もしくは偽関節のため、本品のゆるみ・破損を招き、良好な手術結果が得られないおそれがある] (2)本品材料に対する過敏症の患者 (3)金属に対する過敏症の患者
2.再使用禁止 3.併用医療機器
以下の医療機器と併用しないこと (1)材質の異なるインプラントと併用しないこと[「3.相互作用」の項参照]
|
形状・構造及び原理等
1.原材料
コバルトクロム合金
*2.形状・構造
以下を参照のこと。
(1)ロッド:
| 構成品目の名称 | 形状(例) |
| コバルトクロム ロッド 5.5 ストレート |
 |
| サイズ:径 5.5mm、長 130.5〜610.5mm | |
| コバルトクロム PRCTRD ロッド 5.5 |
 |
| サイズ:径 5.5mm、長:373〜502mm | |
3.原理
脊椎ロッド以外の脊椎内固定器具と組み合わせて機械的にアライメント補正を行い、脊椎を固定支持する。
使用目的又は効果
本品は、胸椎、腰椎および仙椎における、変性疾患(すべり症、脊柱管狭窄症等)、外傷、腫瘍等による不安定性を有する患者、または脊柱変形(脊椎側弯症等)を有する患者に対して、脊椎の一時的な固定、支持またはアライメント補正を目的に使用する。
使用方法等
1.滅菌方法
本品は洗浄・滅菌した後に使用すること。
本品は、以下の推奨滅菌条件もしくは医療機関内で担保された滅菌条件にて滅菌を行うこと。
[推奨滅菌条件]
滅菌方法:高圧蒸気滅菌
滅菌条件:プレバキューム132℃、6分
2.使用方法
以下に脊椎外科の脊椎固定術における本品の一般的な使用方法を示す。
組み合わせて使用する医療機器:
併用するインプラント及び手術器械は、以下等の弊社取扱いのインプラント(脊椎内固定器具)と脊椎手術器械に限定する。
販売名:MOSS MIAMI Expedium システム
承認番号:21800BZY10033000
販売名:Expedium LIS-VIPER システム
承認番号:22100BZX00468000
販売名:VIPER2 スパインシステム
承認番号:22400BZX00042000
※印のついた又は届出番号の記載がある脊椎内固定器具、手術器械は本品には含まれない。
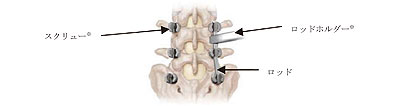
(1)ロッドの設置、セットスクリューでの仮固定
1)予め脊椎に設置されたスクリュー※、フック※に脊椎の矯正/固定形状に合わせたロッドを設置しセットスクリュー※で仮固定する。ロッドのベンディングには各種ロッドベンダー※を用いる。ロッド設置の際には、必要に応じて、本品のヘックス(六角)形状の端には「Expedium 器械セット」(届出番号13B1X00204DS0026)に含まれるロッドローテーションヘックスレンチを、他端には「VIPER2 器械セット」(届出番号13B1X00204DS0052)に含まれるVPR2 アングルドロッドホルダー又はVPR2 アドバンストロッドホルダーをそれぞれ用いる。
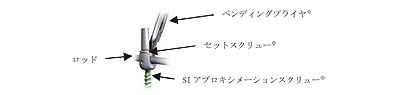
(2)セットスクリューの最終締結
1)スクリュー※、フック※に設置されたセットスクリュー※をトルクレンチハンドル※等を用いて最終締結を行う。

SI アプロキシメーションスクリュー※を設置した場合は、最終締結後にタブをカットする。
必要に応じてトランスバース固定器※を使用する。
(3)抜去(本品を医師の判断によって抜去する場合)
1)手術用器械(セットスクリュードライバー※)をセットスクリュー※にセットした後、設置時とは逆の方向に手術用器械を回転し、セットスクリュー※を外す。
2)次にロッドを取り除く。
3)最後に、手術用器械(スクリュードライバー※)をスクリュー※にセットした後、設置時とは逆の方向に手術用器械を回転し、スクリュー※を抜去した後閉創する。
<使用方法等に関連する使用上の注意>
1.術前の注意
(1)使用前の点検において本品および本品専用の手術器械が揃っていること、また正常に作動することを確認すること。
(2)キズ・破損・変形、その他の異常が認められた場合は適切な表示を行い、返送すること。
(3)本品は未滅菌品のため、使用前に洗浄し、【使用方法等】「滅菌方法」による滅菌を行うこと。
*(4)特に指定のない限り、異なる材料で作られたインプラントとは互換性がない。下の表はインプラント材料の互換性を示している。
| 材料 | 互換性 |
| チタン合金 | チタン合金、コバルト-クロム-モリブデン、コバルト-ニッケル-クロム-モリブデン、PEEK、純チタン |
2.術中の注意
(1)本品は先端が鋭利なものが含まれるため取り扱いには十分に注意すること。
(2)適切なサイズ、形状、デザインの本品を選択すること。
(3)インプラント設置時(特にスクリュー挿入時)には、無理な力を加えないこと。
(4)埋植後本品が適正な位置に設置されていることをX線撮影等により確認すること。
(5)ロッドのベンディングが不適切であると、セットスクリューによる締結力が十分に得られない可能性があるので、ロッドのベンディングを適切に行い、同時にスクリュー、フック、コネクター等連結部のロッド設置位置、設置角度についても十分に確認を行うこと。
(6)ロッドのベンディングの際は、曲げ戻しはしないこと。
(7)本品を締結する場合は、専用手術器械を嵌合部に確実に装着し、本品との軸方向を維持しながら正しく締結すること。
3.術後の注意
(1)手術室に搬入された本品については、未使用であっても、医療用中性洗剤を用いて洗浄し、血液等の異物がついていないか確認した後、滅菌し乾燥すること。
使用上の注意
1.使用注意(次の患者には慎重に適用すること)
(1)精神病・認知症・アルコール中毒・薬物乱用患者[必要な制限や注意を守ることができない場合、治療効果が得られないおそれがあるため]
(2)喫煙習慣のある患者[術後に偽関節が発生するまたは椎間板の変性が進行し、遅発性の臨床失敗につながるおそれがあるため]
(3)重度骨粗鬆症の患者[固定力が不十分となるおそれがあるため]
(4)腫瘍に対する放射線療法や化学療法が行われている患者[骨癒合率が低くなるおそれがあるため]
(5)人工透析が行われている患者[骨癒合率が低くなるおそれがあるため]
(6)骨減少症の患者などの骨癒合を阻害する可能性がある治療が行われている患者、または症状を有する患者[癒合率が低くなるおそれがあるため]
(7)重度の肥満患者・進行性の変性疾患の患者[過大な負荷による本品の破損および治療の不成功のおそれがあるため]
2.重要な基本的注意
(1)医師は、術前に手術に伴う当該患者の身体的、精神的な制限、手術内容、インプラントについて患者に説明し、患者の同意を得ること(インフォームドコンセントを実施すること)。その際に、インプラントの限界とその使用により起こり得る事象、医師の術後指示に従う必要性、特に体重の問題と活動の制限について説明を加えること。
(2)医師は、術後回復期における活動制限について、患者に指示を与え定期的に術後検査を行い骨癒合および本品の状態を観察すること。
(3)骨移植をして骨癒合が完成するまでの期間は、身体活動などにより過度な負荷がかかると本品の破損のおそれがあるため、注意すること。特に前方要素の再建を行わない場合、骨移植を行わない治療法の場合、或いは患者の脊柱変形が大きくその矯正度合いが過大な場合、十分に注意すること。
(4)X線撮影等により十分な骨癒合が確認されるまでは外固定(装具等)の併用を推奨する。
*(5)治癒遅延又は骨癒合不全が起こった骨あるいは治癒が不完全な状態を確実に固定し得なかった場合、インプラントに繰り返し過剰な負荷が加わる結果となり、疲労のメカニズムによって、これらの負荷がインプラントの弛緩、脱転、湾曲又は破損の原因となる場合がある。骨癒合不全が起こった場合、又はインプラントの弛緩、脱転、湾曲又は破損が発生した場合には、重篤な損傷が起こる前に直ちにインプラントを取り替えるか抜去する必要がある。
(6)術後、放射線治療を行うことにより遷延癒合もしくは偽関節が起こる可能性があるため留意すること。
(7)本品の破損、もしくは本品使用に起因する器械の破損により破片が生じた場合、確実に体内より除去すること。
*(8)良好な骨癒合が得られた際、またインプラントの損傷により、抜去術が生じることを患者へ説明すること。抜去術の際においても手技のリスクを説明すること。
*(9)非臨床試験によって本品はMR Conditionalであることが示されている。本品を装着した患者に対して、以下に示される条件下においては、安全にMR検査を実施することが可能である(自己認証による)。
・静磁場強度 1.5T, 3.0T
・静磁場強度の勾配 19T/m, 1,900Gauss/cm
・MR装置が示す全身最大SAR(Specific Absorption Rate)2W/kg(通常操作モード)
上記条件で7分間のスキャン時間において本品に生じ得る最大の温度上昇は8.7℃以下である。さらに、上記条件にて追加のスキャンが必要な場合は、本品を冷却するためにスキャン時間以上の時間をとることを推奨する。
また、MR装置が示す全身最大SARが1W/kgの条件においては、15分間のスキャン時間において本品に生じ得る最大の温度上昇は5.2℃以下である。
本品が3TのMR装置における勾配磁場エコー法による撮像で生じうるアーチファクトは本品の実像から約70mmである。
T:Tesla、磁束密度の単位、1T=10,000 Gauss、SAR:単位組織質量あたりの吸収熱量、単位はW/kg
3.相互作用(他の医療機器との併用に関すること)
併用禁忌(併用しないこと)
| 医療機器の名称等 | 臨床症状・措置方法 | 機序・危険因子 |
| 材質の異なるインプラント(適合性が確認されている弊社取扱製品は除く) | 腐食による破損のおそれがある。 | 異種金属の隣接により電気化学的腐食が促進される。 |
併用注意(併用に注意すること)
併用しないことを原則とするが、止むを得ず併用する場合は、使用上の注意を十分に遵守した上で併用すること
| 医療機器の名称等 | 臨床症状・措置方法 | 機序・危険因子 |
| 骨セメント | 本品の抜去を困難または不可能にする。 | 本品と骨とが強固に固着する。 |
| 神経損傷または骨壊死を引き起こすおそれがある。 | 固化過程で発熱する。 |
4.不具合・有害事象
本品の使用により、他の類似する脊椎内固定器具と同様に以下の不具合が起こりうる。
(1)重大な不具合
- 本品のゆるみ・変形または破損
*- 局所的な組織反応または疼痛を伴う本品の腐食
(2)重大な有害事象
*- インプラント位置の移動による組織損傷
- 早期感染あるいは遅発性感染症
- 空気・血液凝固等による塞栓
- 応力遮蔽による骨密度の低下
- 手術外傷または本品による神経または組織の損傷
*- 滑液包炎
- 麻痺
*- リンパ管の損傷やリンパ液の滲出
*- 脊髄圧迫・挫傷
- 硬膜裂傷・慢性脳脊髄液漏・瘻孔または髄膜炎
- 死亡
- 手術外傷または誤って大動脈や大静脈に隣接して設置された本品による術後回復期の異常出血
- 骨折
- 骨癒合した脊椎隣接椎間の変性または不安定性
- 局所的な組織反応または疼痛
- 遅発性の過敏症やアレルギー反応の発症
- 本品がその使用目的を完遂した後も抜去されない場合、上述の「重大な有害事象」が起こりうる。
(3)その他の有害事象
*- 癒合不全(偽関節)、癒合遅延、変形癒合
- 本品の使用に際する手術従事者の受傷[本品には、先端が鋭利なものが含まれる]
5.高齢者への適用
(1)骨密度が低下した高齢者は、術中に過度の力を加えることにより骨折または、本品埋植後にゆるみ等が起こる可能性が高いため慎重に使用すること。
6.妊婦、産婦、授乳婦および小児等への適用
(1)妊婦、産婦、授乳婦へは使用しないことを原則とするが、不安定性骨折に対する脊椎内固定等、特に必要とする場合は、慎重に使用すること。
(2)小児に対する安全性は確立していない。
7.その他の注意
(1)本品の使用により骨癒合が確認された場合であっても、重量物の持ち上げ・筋肉の緊張・体のひねり・反復屈伸・前屈・ランニング・長時間の歩行・肉体労働等が制限されることがある。
保管方法及び有効期間等
1.保管方法
(1)室温保存
(2)高温、多湿、直射日光を避けて保管すること。
製造販売業者及び製造業者の氏名又は名称等
氏名又は名称(製造販売業の種別)
ジョンソン・エンド・ジョンソン株式会社
第一種医療機器製造販売業
住所等
電話番号
03-4411-6133