コデインリン酸塩錠20mg「第一三共」
作成又は改訂年月
| ** | 2022年 12月改訂 ( 第3版 ) |
| * | 2021年 4月改訂 ( 第2版 ) |
日本標準商品分類番号
薬効分類名
承認等
一般的名称
2. 禁忌(次の患者には投与しないこと)
- 2.1 重篤な呼吸抑制のある患者[呼吸抑制を増強する。]
- 2.2 12歳未満の小児
- 2.3 扁桃摘除術後又はアデノイド切除術後の鎮痛目的で使用する18歳未満の患者[重篤な呼吸抑制のリスクが増加するおそれがある。]
- 2.4 気管支喘息発作中の患者[気道分泌を妨げる。]
- 2.5 重篤な肝機能障害のある患者
- 2.6 慢性肺疾患に続発する心不全の患者[呼吸抑制や循環不全を増強する。]
- 2.7 痙攣状態(てんかん重積症、破傷風、ストリキニーネ中毒)にある患者[脊髄の刺激効果があらわれる。]
- 2.8 急性アルコール中毒の患者[呼吸抑制を増強する。]
- 2.9 アヘンアルカロイドに対し過敏症の患者
- 2.10 出血性大腸炎の患者[腸管出血性大腸菌(O157等)や赤痢菌等の重篤な細菌性下痢のある患者では、症状の悪化、治療期間の延長をきたすおそれがある。]
3. 組成・性状
6. 用法及び用量
通常、成人には、コデインリン酸塩水和物として、1回20mg、1日60mgを経口投与する。
なお、年齢、症状により適宜増減する。
8. 重要な基本的注意
9. 特定の背景を有する患者に関する注意
9.1 合併症・既往歴等のある患者
-
9.1.1 細菌性下痢のある患者
治療上やむを得ないと判断される場合を除き、投与しないこと。治療期間の延長をきたすおそれがある。
-
9.1.2 18歳未満の肥満、閉塞性睡眠時無呼吸症候群又は重篤な肺疾患を有する患者
投与しないこと。重篤な呼吸抑制のリスクが増加するおそれがある。
-
9.1.3 心機能障害のある患者
循環不全を増強するおそれがある。
-
9.1.4 呼吸機能障害のある患者
呼吸抑制を増強するおそれがある。
-
9.1.5 脳に器質的障害のある患者
呼吸抑制や頭蓋内圧の上昇を起こすおそれがある。
-
9.1.6 ショック状態にある患者
循環不全や呼吸抑制を増強するおそれがある。
-
9.1.7 代謝性アシドーシスのある患者
呼吸抑制を起こすおそれがある。
-
9.1.8 甲状腺機能低下症(粘液水腫等)の患者
呼吸抑制や昏睡を起こすおそれがある。
-
9.1.9 副腎皮質機能低下症(アジソン病等)の患者
呼吸抑制作用に対し、感受性が高くなっている。
-
9.1.10 薬物依存の既往歴のある患者
依存性を生じやすい。
-
9.1.11 衰弱者
呼吸抑制作用に対し、感受性が高くなっている。
-
9.1.12 前立腺肥大による排尿障害、尿道狭窄、尿路手術術後の患者
排尿障害を増悪することがある。
-
9.1.13 器質的幽門狭窄、麻痺性イレウス又は最近消化管手術を行った患者
消化管運動を抑制する。
-
9.1.14 痙攣の既往歴のある患者
痙攣を誘発するおそれがある。
-
9.1.15 胆嚢障害及び胆石のある患者
胆道痙攣を起こすことがある。
-
9.1.16 重篤な炎症性腸疾患のある患者
連用した場合、巨大結腸症を起こすおそれがある。
9.2 腎機能障害患者
排泄が遅延し、副作用があらわれるおそれがある。
9.3 肝機能障害患者
9.5 妊婦
妊婦又は妊娠している可能性のある女性には、治療上の有益性が危険性を上回ると判断される場合にのみ投与すること。動物実験(マウス)で催奇形作用が報告されている。
分娩前に投与した場合、出産後新生児に退薬症候(多動、神経過敏、不眠、振戦等)があらわれることがある。
分娩時の投与により、新生児に呼吸抑制があらわれるとの報告がある。
9.6 授乳婦
9.7 小児等
9.8 高齢者
低用量から投与を開始するなど患者の状態を観察しながら、慎重に投与すること。一般に生理機能が低下しており、特に呼吸抑制の感受性が高い。
10. 相互作用
11. 副作用
11.1 重大な副作用
-
11.1.1 依存性(頻度不明)
連用により生じることがある。また、連用中における投与量の急激な減少ないし投与の中止により、あくび、くしゃみ、流涙、発汗、悪心、嘔吐、下痢、腹痛、散瞳、頭痛、不眠、不安、せん妄、振戦、全身の筋肉・関節痛、呼吸促迫等の退薬症候があらわれることがあるので、投与を中止する場合には、1日用量を徐々に減量するなど、患者の状態を観察しながら行うこと。
-
11.1.2 呼吸抑制(頻度不明)
息切れ、呼吸緩慢、不規則な呼吸、呼吸異常等があらわれた場合には、投与を中止するなど適切な処置を行うこと。なお、本剤による呼吸抑制には、麻薬拮抗剤(ナロキソン、レバロルファン等)が拮抗する。
- 11.1.3 錯乱、せん妄(頻度不明)
- 11.1.4 無気肺、気管支痙攣、喉頭浮腫(頻度不明)
-
11.1.5 麻痺性イレウス、中毒性巨大結腸(頻度不明)
炎症性腸疾患の患者に投与した場合にあらわれるとの報告がある。
11.2 その他の副作用
|
頻度不明 |
|
|---|---|
|
循環器 |
不整脈、血圧変動、顔面潮紅 |
|
精神神経系 |
眠気、めまい、視調節障害、発汗 |
|
消化器 |
悪心、嘔吐、便秘 |
|
過敏症 |
発疹、そう痒感 |
|
その他 |
排尿障害 |
13. 過量投与
14. 適用上の注意
15. その他の注意
18. 薬効薬理
18.1 作用機序
投与されたコデインの5~15%が肝薬物代謝酵素CYP2D6によりO-脱メチル化を受けてモルヒネに代謝変換され鎮痛作用を示す。また、モルヒネと同様に、咳中枢に作用して咳反射を抑制する。鎮痛効果はモルヒネの1/6、精神機能鎮静作用は1/4、睡眠作用も1/4、鎮咳効果は1/8~1/9とされている6) 。
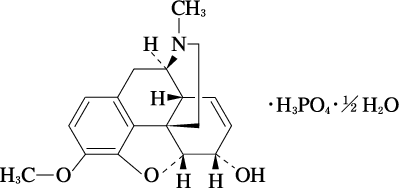
19. 有効成分に関する理化学的知見
一般的名称
コデインリン酸塩水和物
(Codeine Phosphate Hydrate)
化学名
(5R,6S)-4,5-Epoxy-3-methoxy-17-methyl-7,8-didehydromorphinan-6-ol monophosphate hemihydrate
分子式
C18H21NO3・H3PO4・1/2H2O
分子量
406.37
性状
白色~帯黄白色の結晶又は結晶性の粉末である。
水又は酢酸(100)に溶けやすく、メタノール又はエタノール(95)に溶けにくく、ジエチルエーテルにほとんど溶けない。
1.0gを水10mLに溶かした液のpHは3.0~5.0である。
光によって変化する。
化学構造式
20. 取扱い上の注意
**PTPシートから取り出し後又は瓶開封後は湿気を避けて保存すること。
22. 包装
(瓶:バラ) 50錠 100錠
(PTP) 50錠(10錠×5) 100錠(10錠×10)
23. 主要文献
24. 文献請求先及び問い合わせ先
第一三共株式会社 製品情報センター
〒103-8426 東京都中央区日本橋本町3-5-1
TEL:0120-065-132(がん・医療用麻薬専用)
25. 保険給付上の注意
本剤は厚生労働省告示第75号(平成24年3月5日付)に基づき、1回30日分を限度として投薬する。
26. 製造販売業者等
26.1 製造販売元
第一三共プロファーマ株式会社
東京都中央区日本橋本町3-5-1
26.2 販売元
第一三共株式会社
東京都中央区日本橋本町3-5-1