イソビスト注300
作成又は改訂年月
| 2022年 1月改訂 ( 第1版 ) |
日本標準商品分類番号
877219
薬効分類名
非イオン性 子宮卵管・関節造影剤
承認等
イソビスト注300
販売名コード
YJコード
7219414A2032
販売名英語表記
Isovist injection 300
販売名ひらがな
いそびすとちゅう300
承認番号等
承認番号
21800AMX10341000
販売開始年月
1991年
12月
貯法・有効期間
貯法
室温保存
有効期間
36ヵ月
規制区分
処方箋医薬品 注)
注) 注意―医師等の処方箋により使用すること一般的名称
イオトロラン
3. 組成・性状
6. 用法及び用量
8. 重要な基本的注意
- 8.1 ショック等の発現に備え、十分な問診を行うこと。,,,,
- 8.2 投与量と投与方法の如何にかかわらず過敏反応を示すことがある。本剤によるショック等の重篤な副作用は、ヨード過敏反応によるものとは限らず、それを確実に予知できる方法はないので、投与に際しては必ず救急処置の準備を行うこと。,,
- 8.3 ショック等の重篤な副作用があらわれることがあるので、投与にあたっては、開始時より患者の状態を観察しながら、慎重に投与すること。過敏反応の発現等異常が認められた場合には、直ちに投与を中止し、適切な処置を行うこと。また、投与後も患者の状態を十分に観察すること。,,
- 8.4 遅発性副作用に備えて、検査終了数時間後にも副作用発現の可能性があることを患者に説明した上で、発疹、悪心等が発現した場合には速やかに主治医等に連絡するよう注意を与えること。
9. 特定の背景を有する患者に関する注意
10. 相互作用
12. 臨床検査結果に及ぼす影響
本剤投与により、甲状腺機能検査等の放射性ヨードによる検査に影響を及ぼすことがある。したがって、これらの検査は本剤投与前に実施すること。本剤投与後1ヵ月間はこれらの検査に影響を及ぼすとの報告がある。
16. 薬物動態
17. 臨床成績
17.1 有効性及び安全性に関する試験
-
〈子宮卵管撮影〉
-
17.1.1 国内第Ⅱ相及び第Ⅲ相臨床試験
比較臨床試験2) を含む国内第Ⅱ相及び第Ⅲ相臨床試験における有効率は94.8%(92/97例)であった。
-
17.1.1 国内第Ⅱ相及び第Ⅲ相臨床試験
- 〈関節撮影〉
19. 有効成分に関する理化学的知見
一般的名称
イオトロラン(Iotrolan)
化学名
A diastereomeric mixture of 5,5’-[malonylbis-(methylimino)]bis[N,N’-bis[2,3-dihydroxy-1-(hydroxymethyl)propyl]-2,4,6-triiodoisophthalamide]
分子式
C37H48I6N6O18
分子量
1626.23
性状
本品は白色の粉末又は塊で、においはなく、味は甘い。
本品は水に極めて溶けやすく、メタノールにやや溶けにくく、エタノール(95)に溶けにくく、ジエチルエーテルにほとんど溶けない。
本品は吸湿性である。
本品の水溶液(1→10)は旋光性を示さない。
化学構造式
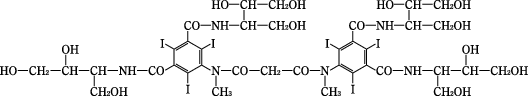
20. 取扱い上の注意
外箱開封後は遮光して保存すること。
22. 包装
10mL[5瓶]
24. 文献請求先及び問い合わせ先
文献請求先
バイエル薬品株式会社・メディカルインフォメーション
〒530-0001大阪市北区梅田二丁目4番9号
バイエル医療用医薬品のお問い合わせ先
電話0120-106-398
26. 製造販売業者等
26.1 製造販売元
バイエル薬品株式会社
大阪市北区梅田二丁目4番9号