トスフロキサシントシル酸塩小児用細粒15%「明治」
作成又は改訂年月
| * | 2021年 12月改訂 ( 第1版 ) |
日本標準商品分類番号
薬効分類名
承認等
トスフロキサシントシル酸塩小児用細粒15%「明治」
販売名コード
YJコード
販売名英語表記
販売名ひらがな
承認番号等
承認番号
販売開始年月
貯法・有効期間
貯法
有効期間
規制区分
処方箋医薬品 注)
注) 注意―医師等の処方箋により使用すること一般的名称
3. 組成・性状
4. 効能又は効果
5. 効能又は効果に関連する注意
- 〈効能共通〉
- 〈肺炎〉
-
〈中耳炎〉
- 5.5 肺炎球菌(ペニシリンGに対するMIC≧4μg/mL)に対する本剤の使用経験はない(CLSI法)。
- 5.6 インフルエンザ菌にはβ-ラクタム耐性インフルエンザ菌を含む。
- 5.7 「抗微生物薬適正使用の手引き」1) を参照し、抗菌薬投与の必要性を判断した上で、本剤の投与が適切と判断される場合に投与すること。
6. 用法及び用量
通常、小児に対してはトスフロキサシントシル酸塩水和物として1回6mg/kg(トスフロキサシンとして4.1mg/kg)を1日2回経口投与する。
ただし、1回180mg、1日360mg(トスフロキサシンとして1回122.4mg、1日244.8mg)を超えないこととする。
7. 用法及び用量に関連する注意
9. 特定の背景を有する患者に関する注意
10. 相互作用
10.2 併用注意(併用に注意すること)
| 薬剤名等 | 臨床症状・措置方法 | 機序・危険因子 |
|---|---|---|
|
テオフィリン |
健康成人にテオフィリン1日400mgとトスフロキサシントシル酸塩水和物(錠剤)1日450mgを併用したところ、テオフィリンの最高血中濃度は、併用3日目で1.13倍、5日目では1.23倍の上昇を示したとの報告がある。 |
機序:テオフィリンの肝での代謝を抑制し、血中濃度を上昇させることが報告されている。 |
|
痙攣があらわれることがある。 |
機序:中枢神経におけるGABAA受容体への結合阻害作用が非ステロイド性消炎鎮痛剤により増強されることが主な機序と考えられている。 |
|
|
本剤の効果が減弱されるおそれがある。 |
機序:金属カチオンと難溶性の錯塩を形成し、本剤の消化管からの吸収が低下することが報告されている。 |
|
|
腱障害のリスクが増大するとの報告がある。これらの薬剤との併用は、治療上の有益性が危険性を上回る場合のみとすること。 |
機序不明 |
11. 副作用
11.1 重大な副作用
- 11.1.1 ショック、アナフィラキシー(呼吸困難、浮腫、発赤等)(いずれも頻度不明)
- 11.1.2 中毒性表皮壊死融解症(Toxic Epidermal Necrolysis:TEN)、皮膚粘膜眼症候群(Stevens-Johnson症候群)(いずれも頻度不明)
- 11.1.3 痙攣、意識障害(意識喪失等)(いずれも頻度不明)
- 11.1.4 急性腎障害、間質性腎炎、腎性尿崩症(いずれも頻度不明)
- 11.1.5 肝機能障害、黄疸(いずれも頻度不明)
-
11.1.6 無顆粒球症、血小板減少(いずれも頻度不明)
発熱、咽頭痛、皮下・粘膜出血等があらわれた場合には血液検査を行い、異常が認められた場合には投与を中止し、適切な処置を行うこと。
-
11.1.7 偽膜性大腸炎等の血便を伴う重篤な大腸炎(頻度不明)
腹痛、頻回の下痢があらわれた場合には、直ちに投与を中止するなど適切な処置を行うこと。
-
11.1.8 間質性肺炎、好酸球性肺炎(いずれも頻度不明)
発熱、咳嗽、呼吸困難、胸部X線異常、好酸球増多等を伴う間質性肺炎、好酸球性肺炎等があらわれることがあるので、このような症状があらわれた場合には投与を中止し、副腎皮質ホルモン剤の投与等の適切な処置を行うこと。
-
11.1.9 横紋筋融解症(頻度不明)
急激な腎機能悪化を伴う横紋筋融解症があらわれることがある。筋肉痛、脱力感、CK上昇、血中及び尿中ミオグロビン上昇があらわれた場合には投与を中止し、適切な処置を行うこと。
-
11.1.10 低血糖(頻度不明)
高齢者、腎障害患者、糖尿病患者であらわれやすい。
- 11.1.11 大動脈瘤、大動脈解離(いずれも頻度不明)
-
11.1.12 末梢神経障害(頻度不明)
しびれ、筋力低下、痛み等の症状が認められた場合には投与を中止し、適切な処置を行うこと。
-
11.1.13 アキレス腱炎、腱断裂等の腱障害(頻度不明)
腱周辺の痛み、浮腫、発赤等の症状が認められた場合には投与を中止し、適切な処置を行うこと。[9.8.1参照]
-
11.1.14 精神症状(頻度不明)
幻覚、せん妄等の精神症状があらわれることがある。
- 11.1.15 重症筋無力症の悪化(頻度不明)
11.2 その他の副作用
|
1%以上 |
1%未満 |
頻度不明 |
|
|---|---|---|---|
|
過敏症 |
発熱、発疹、紅斑 |
潮紅、そう痒症、湿疹、蕁麻疹 |
光線過敏性反応 |
|
腎臓 |
尿円柱 |
尿中血陽性、尿中赤血球陽性、遺尿、BUN増加、血尿 |
血中クレアチニン増加 |
|
肝臓 |
― |
AST増加、ALT増加、ALP増加、LDH増加、γ-GTP増加、ビリルビン増加 |
― |
|
消化器 |
下痢(5.2%)、嘔吐(3.7%)、食欲不振、腹痛、口渇、便秘 |
悪心、口唇水疱、腹部膨満、胃・腹部不快感、口内炎、舌炎 |
― |
|
血液 |
好酸球数増加、白血球数減少 |
単球数増加 |
血小板数減少、貧血 |
|
精神神経系 |
傾眠 |
せん妄、頭痛、浮動性めまい、しびれ、不眠症、振戦 |
幻覚 |
|
その他 |
― |
関節痛、蒼白、血中CK増加、血中クロール減少、血中クロール増加、亀頭包皮炎、倦怠感 |
味覚異常 |
15. その他の注意
15.1 臨床使用に基づく情報
15.2 非臨床試験に基づく情報
動物実験(幼若イヌ)で50mg/kg、500mg/kgを14日間経口投与した結果、関節異常(上腕骨近位端軟骨に微小水疱あるいはびらん)が認められたとの報告がある4) 。,,
16. 薬物動態
16.1 血中濃度
-
16.1.1 小児患者
肺炎及び中耳炎の小児患者に15%細粒剤を1回6mg/kg又は9mg/kgを1日2回反復経口投与※したときの薬物動態パラメータは、下表のとおりであった[Population Pharmacokinetics(PPK)解析]。
※本剤の承認用量は1回6mg/kgを1日2回である。投与量
例数
AUC
(μg・hr/mL)Cmax
(μg/mL)Tmax
(hr)T1/2
(hr)6mg/kg
165
7.58±2.38
0.96±0.30
2.0±0.2
3.8±0.5
9mg/kg
57
12.51±6.24
1.48±0.54
2.1±0.3
4.0±0.8
PKパラメータはNONMEMによるベイズ推定値
Mean±S.D.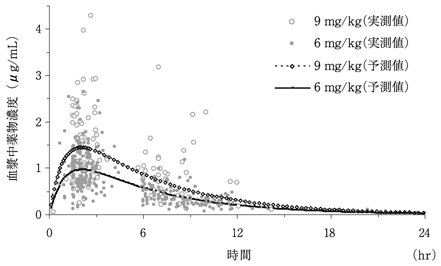
図 血漿中トスフロキサシン濃度予測推移
16.3 分布
16.4 代謝
健康成人6例に150mg(錠剤)を食後単回経口投与したとき、大部分が未変化体として尿中及び糞中に排泄されたが、未変化体以外に2種の代謝物及びこれらの抱合体が尿中に確認された7) 。
16.5 排泄
16.6 特定の背景を有する患者
-
16.6.1 腎機能障害者の血中濃度
腎機能障害者(成人)に150mg(錠剤)を食後単回経口投与したとき、下表のとおり、腎機能の低下に伴い血中半減期(T1/2)の延長が認められた9) 。,
腎機能障害の程度(Ccr:mL/min)
例数
T1/2(hr)
正常者(Ccr≧80)
5
3.9
軽度(80>Ccr≧50)
3
4.0
中等度(50>Ccr≧20)
2
9.8
高度(20>Ccr)
4
10.5
-
16.6.2 透析患者の血中濃度
血液透析患者(成人)2例に150mg(錠剤)を食後単回経口投与したとき、それぞれ投与1.5時間後に1.65μg/mL、3時間後に1.6μg/mLの血中濃度ピーク値を示し、5時間の透析で透析液中に7.31%及び8.33%が回収された9) 。
17. 臨床成績
17.1 有効性及び安全性に関する試験
肺炎及び中耳炎を対象とした臨床試験の概要は次のとおりである。なお、コレラ、炭疽に関する臨床試験は国内外において実施していない。
-
〈肺炎、中耳炎〉
-
17.1.1 国内第Ⅲ相試験
肺炎及び中耳炎の小児患者を対象に1回6mg/kg又は9mg/kgを1日2回投与※した15%細粒剤の臨床試験における疾患別の有効率は下表のとおりであった。
※本剤の承認用量は1回6mg/kgを1日2回である。疾患名
有効例数/解析対象例数
有効率注1)(%)
肺炎
48/48
100
中耳炎
157/162
96.9
菌種別菌消失率は下表のとおりであった。
菌種
消失株数/評価株数
菌消失率注2)(%)
肺炎球菌
49/61
80.3
PISP注3)
23/31
74.2
PRSP注3)
7/9
77.8
モラクセラ(ブランハメラ)・カタラーリス
(β-ラクタマーゼ産生菌)14/14
100
インフルエンザ菌
66/70
94.3
BLNAS
50/53
94.3
BLNAR
11/12
91.7
BLPAR
3/3
100
BLPACR
2/2
100
PISP:Penicillin-intermediate S. pneumoniae
PRSP:Penicillin-resistant S. pneumoniae
BLNAS:β-Lactamase-negative ampicillin-susceptible H. influenzae
BLNAR:β-Lactamase-negative ampicillin-resistant H. influenzae
BLPAR:β-Lactamase-positive ampicillin-resistant H. influenzae
BLPACR:β-Lactamase-positive amoxicillin/clavulanic acid-resistant H. influenzae -
17.1.2 国内第Ⅲ相試験
マイコプラズマ肺炎の小児患者を対象に1回6mg/kgを1日2回投与(投与期間:9.8±2.9日※※)した15%細粒剤の臨床試験における有効率は下表のとおりであった。
※※Mean±S.D.疾患名
有効例数/解析対象例数注4)
有効率注1)(%)
マイコプラズマ肺炎
32/33
97.0
菌消失率は下表のとおりであった(投与期間:8~13日)。
菌種
消失株数/評価株数
菌消失率注2)(%)
肺炎マイコプラズマ(マイコプラズマ・ニューモニエ)
4/4
100
副作用発現頻度(臨床検査値異常を含む)は15.2%(5/33例)で、主な副作用は、便秘6.1%(2/33例)であった。
注1)投与終了時又は中止時の有効率
注2)投与終了時又は中止時の菌消失率
注3)CLSI(Clinical and Laboratory Standards Institute)の判定基準に基づき、Penicillin(Oral penicillin V)に対するMICが0.12~1μg/mLの場合をPISP、2μg/mL以上の場合をPRSPと判定した。
注4)マイコプラズマ肺炎の疑いを含む
-
17.1.1 国内第Ⅲ相試験
18. 薬効薬理
19. 有効成分に関する理化学的知見
一般的名称
トスフロキサシントシル酸塩水和物
(Tosufloxacin Tosilate Hydrate)
化学名
7-[(3RS)-3-Aminopyrrolidin-1-yl]-1-(2,4-difluorophenyl)-6-fluoro-4-oxo-1,4-dihydro-1,8-naphthyridine-3-carboxylic acid mono-4-toluenesulfonate monohydrate
分子式
C19H15F3N4O3・C7H8O3S・H2O
分子量
594.56
性状
トスフロキサシントシル酸塩水和物は白色~微黄白色の結晶性の粉末である。
本品はN,N -ジメチルホルムアミドに溶けやすく、メタノールにやや溶けにくく、水又はエタノール(99.5)にほとんど溶けない。
本品のメタノール溶液(1→100)は旋光性を示さない。
化学構造式
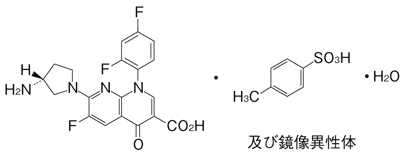
融点
約254℃(分解)
略 号
TFLX
22. 包装
バラ包装(ボトル入) 50g 100g
分包包装 0.5g×40包(2連包×20)
23. 主要文献
1) 厚生労働省健康局結核感染症課編:抗微生物薬適正使用の手引き
2) Sieb,J.P.:Neurology.1998;50:804-807
3) 中村 孝ほか:Chemotherapy.1988;36(S-9):710-726
5) 那須 勝ほか:Chemotherapy.1988;36(S-9):699-709
6) 河村正三ほか:Chemotherapy.1988;36(S-9):1341-1353
7) 田井 賢ほか:Chemotherapy.1988;36(S-9):208-215
8) 中島光好ほか:Chemotherapy.1988;36(S-9):158-180
24. 文献請求先及び問い合わせ先
Meiji Seika ファルマ株式会社 くすり相談室
〒104-8002 東京都中央区京橋2-4-16
フリーダイヤル(0120)093-396 電話(03)3273-3539
FAX(03)3272-2438
26. 製造販売業者等
26.1 製造販売元
Meiji Seika ファルマ株式会社
東京都中央区京橋2-4-16