デベルザ錠20mg
作成又は改訂年月
| 2019年 10月改訂 ( 第1版 ) |
日本標準商品分類番号
薬効分類名
承認等
デベルザ錠20mg
販売名コード
YJコード
販売名英語表記
販売名ひらがな
承認番号等
承認番号
販売開始年月
貯法・有効期間
貯法
有効期間
規制区分
処方箋医薬品 注)
注) 注意―医師等の処方箋により使用すること一般的名称
3. 組成・性状
4. 効能又は効果
2型糖尿病
5. 効能又は効果に関連する注意
6. 用法及び用量
通常、成人にはトホグリフロジンとして20mgを1日1回朝食前又は朝食後に経口投与する。
8. 重要な基本的注意
- 8.1 本剤の使用にあたっては、患者に対し低血糖症状及びその対処方法について十分説明すること。,
- 8.2 本剤投与中は、血糖値等を定期的に検査し、薬剤の効果を確かめ、3ヵ月投与しても効果が不十分な場合には、より適切な治療法への変更を考慮すること。
- 8.3 本剤投与により、血清クレアチニンの上昇又はeGFRの低下がみられることがあるので、腎機能を定期的に検査するとともに、腎機能障害患者における治療にあたっては経過を十分に観察すること。,,,
- 8.4 尿路感染及び性器感染を起こし、腎盂腎炎、外陰部及び会陰部の壊死性筋膜炎(フルニエ壊疽)、敗血症等の重篤な感染症に至ることがある。十分な観察を行うなど尿路感染及び性器感染の発症に注意し、発症した場合には適切な処置を行うとともに、状態に応じて休薬等を考慮すること。尿路感染及び性器感染の症状及びその対処方法について患者に説明すること。,
- 8.5 本剤の利尿作用により多尿・頻尿がみられることがある。また、体液量が減少することがあるので、適度な水分補給を行うよう指導し、観察を十分に行うこと。特に体液量減少を起こしやすい患者(高齢者や利尿剤併用患者等)においては、脱水や糖尿病性ケトアシドーシス、高浸透圧高血糖症候群、脳梗塞を含む血栓・塞栓症等の発現に注意すること。,,,
-
8.6 本剤の作用機序である尿中グルコース排泄促進作用により、血糖コントロールが良好であっても脂肪酸代謝が亢進し、ケトーシスがあらわれ、ケトアシドーシスに至ることがある。著しい血糖の上昇を伴わない場合があるため、以下の点に留意すること。
- 8.6.1 悪心・嘔吐、食欲減退、腹痛、過度な口渇、倦怠感、呼吸困難、意識障害等の症状が認められた場合には、血中又は尿中ケトン体測定を含む検査を実施すること。
- 8.6.2 特に、インスリン分泌能の低下、インスリン製剤の減量や中止、過度な糖質摂取制限、食事摂取不良、感染症、脱水を伴う場合にはケトアシドーシスを発現しやすいので、観察を十分に行うこと。
- 8.6.3 患者に対し、以下の点を指導すること。
- 8.7 排尿困難、無尿、乏尿あるいは尿閉の症状を呈する患者においては、その治療を優先するとともに他剤での治療を考慮すること。
- 8.8 本剤投与による体重減少が報告されているため、過度の体重減少に注意すること。
- 8.9 低血糖症状を起こすことがあるので、高所作業、自動車の運転等に従事している患者に投与するときは注意すること。
9. 特定の背景を有する患者に関する注意
10. 相互作用
10.2 併用注意(併用に注意すること)
| 薬剤名等 | 臨床症状・措置方法 | 機序・危険因子 |
|---|---|---|
|
低血糖が起こるおそれがある。特にスルホニルウレア剤又はインスリン製剤と併用する場合、低血糖発現のリスクが増加するおそれがあることから、スルホニルウレア剤又はインスリン製剤の減量を検討すること。 |
血糖降下作用の増強による。 |
|
|
低血糖が起こるおそれがある。血糖値、その他患者の状態を十分に観察しながら投与すること。 |
血糖降下作用の増強による。 |
|
|
血糖が上昇するおそれがある。血糖値、その他患者の状態を十分に観察しながら投与すること。 |
血糖降下作用の減弱による。 |
|
|
必要に応じ利尿剤の用量を調整するなど注意するとともに、血圧、脈拍数、尿量、血清ナトリウム濃度等を確認し、脱水症状の発現に注意すること。 |
本剤との併用により、利尿作用が増強されるおそれがある。 |
|
|
併用すると本剤のCmaxが1.22倍、AUCが2.33倍に増加する。 |
機序は不明である。 |
11. 副作用
11.1 重大な副作用
-
11.1.1 低血糖(1.5~38.6%)
低血糖(初期症状:脱力感、高度の空腹感、発汗等)があらわれることがある。低血糖症状が認められた場合には、糖質を含む食品を摂取させるなど適切な処置を行うこと。ただし、α-グルコシダーゼ阻害剤との併用により低血糖症状が認められた場合にはブドウ糖を投与すること。,,,,,,,
-
11.1.2 腎盂腎炎、外陰部及び会陰部の壊死性筋膜炎(フルニエ壊疽)、敗血症(いずれも頻度不明)
腎盂腎炎、外陰部及び会陰部の壊死性筋膜炎(フルニエ壊疽)があらわれ、敗血症(敗血症性ショックを含む)に至ることがある。,
-
11.1.3 脱水(頻度不明)
口渇、多尿、頻尿、血圧低下等の症状があらわれ脱水が疑われる場合には、休薬や補液等の適切な処置を行うこと。脱水に引き続き脳梗塞を含む血栓・塞栓症等を発現した例が報告されているので、十分注意すること。,,,
- 11.1.4 ケトアシドーシス(糖尿病性ケトアシドーシスを含む)(頻度不明)
11.2 その他の副作用
|
5%以上 |
1~5%未満 |
1%未満 |
頻度不明 |
|
|---|---|---|---|---|
|
皮膚 |
発疹 |
そう痒症 |
||
|
腎臓 |
頻尿 |
尿路感染、尿量増加、尿中ケトン体陽性 |
尿路結石、夜間頻尿、尿中β2ミクログロブリン増加 | |
|
消化器 |
便秘、空腹 |
下痢、腹痛 | ||
|
精神神経系 |
めまい |
頭痛 | ||
|
生殖器 |
性器感染(外陰部膣カンジダ症等) |
陰部そう痒症 |
||
|
循環器 |
血圧上昇、起立性低血圧 | |||
|
呼吸器 |
上気道炎 | |||
|
その他 |
血中ケトン体増加、口渇 |
倦怠感、体重減少 |
12. 臨床検査結果に及ぼす影響
本剤の作用機序により、本剤服用中は尿糖陽性、血清1,5-AG(1,5-アンヒドログルシトール)低値を示す。尿糖、血清1,5-AGの検査結果は、血糖コントロールの参考とはならないので注意すること。
14. 適用上の注意
16. 薬物動態
16.1 血中濃度
-
16.1.1 単回投与
健康成人男性(15例)にトホグリフロジン20mgを絶食時単回経口投与した場合の血漿中濃度推移及び薬物動態パラメータを示す1) 。
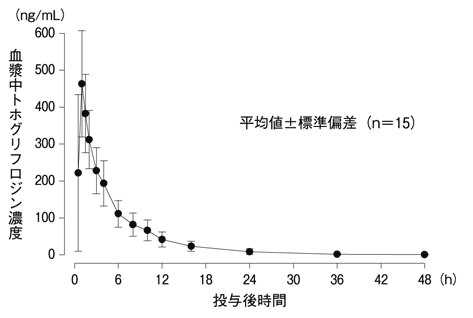
図 健康成人男性における絶食時単回経口投与後の平均血漿中濃度推移 表 健康成人男性における絶食時単回経口投与後の薬物動態パラメータ Cmax
(ng/mL)AUCinf
(ng・h/mL)Tmax
(h)t1/2
(h)509±118
2,140±656
1.10±0.431
5.40±0.622
平均値±標準偏差(n=15)
-
16.1.2 反復投与
健康成人男性(6例)にトホグリフロジン20mgを1日1回7日間食前に反復経口投与した場合、血中濃度は2日目で定常状態に達した。AUC0-24h及びCmaxに関する累積係数(反復投与時/初回投与時)は、それぞれ0.924及び0.861であった2) 。
16.2 吸収
-
16.2.1 食事の影響
健康成人男性(15例)にトホグリフロジン20mgを単回経口投与した場合、絶食投与時に対する食前15分投与時又は食後30分投与時のCmax及びAUCinfの幾何平均の比(90%信頼区間)は、0.879(0.763-1.01)及び0.886(0.846-0.927)又は0.672(0.566-0.797)及び0.926(0.886-0.969)であった1) 。
-
16.2.2 バイオアベイラビリティ
外国人の健康成人男性(6例)において放射性標識体のトホグリフロジン0.1mg静脈内投与 注1) 及び20mg単回経口投与時のAUCinfより算出した絶対的バイオアベイラビリティは97.5%であった3) 。
注1) 本剤の承認された投与経路は経口投与である。
16.3 分布
-
16.3.1 蛋白結合率
ヒト血漿に放射性標識体のトホグリフロジン0.1~10μg/mLを添加したin vitroの検討で、トホグリフロジンの血漿蛋白結合率は82.3~82.6%であった。また、主要代謝物であるカルボン酸体は52.7~55.0%であった(平衡透析法)4) 。
16.4 代謝
-
16.4.1 血漿中代謝物
外国人の健康成人男性(6例)に放射性標識体のトホグリフロジン20mgを経口投与した場合、トホグリフロジン及びカルボン酸体のAUC1-24hは血漿中総放射能量の42%及び52%であった3) 。カルボン酸体はCYP2C18、CYP4A11、CYP4F3B及びアルコール脱水素酵素等によって生成されると推定された4) ,5) 。
-
16.4.2 代謝酵素
トホグリフロジンは、in vitroにおいて、CYP1A2、2B6、2C8、2C9、2C19、2D6及び3A4/5を阻害せず(IC50>50μmol/L)、CYP1A2、2B6及び3A4を誘導しなかった(濃度: 0.5~50μmol/L)4) 。
16.5 排泄
-
16.5.1 尿中及び糞中排泄率
外国人の健康成人男性(6例)に放射性標識体のトホグリフロジン20mgを経口投与した場合、投与放射能量のうち投与48時間後までに尿中に76.2%が、投与96時間後までに糞便中に21.4%が排泄された3) 。
-
16.5.2 トランスポーター
トホグリフロジンは、in vitroにおいて、P-糖タンパク質の基質であるが、P-糖タンパク質を介するジゴキシンの輸送は阻害しなかった(IC50>500μmol/L)。トホグリフロジンは有機アニオントランスポーターOAT1、OAT3、OATP1B1、OATP1B3及び有機カチオントランスポーターOCT2による能動的な輸送は認められず、OATP1B1の基質(シンバスタチン及びフルバスタチン)の取り込みに対して弱い阻害作用を示した(IC50: 各480、370μmol/L)4) 。
16.6 特定の背景を有する患者
-
16.6.1 腎機能障害を有する2型糖尿病患者
外国人の軽度(50≤eGFR≤80mL/min/1.73m2)、中等度(30≤eGFR<50mL/min/1.73m2)及び重度(eGFR<30mL/min/1.73m2)腎機能障害を有する2型糖尿病患者(各8~9例)にトホグリフロジン20mgを経口投与した場合、腎機能が正常(80mL/min/1.73m2<eGFR)な2型糖尿病患者(11例)と比較してトホグリフロジンのCmaxはそれぞれ0.917、0.980及び0.863倍、AUCinfはそれぞれ1.16、1.22及び1.17倍であった。また、上記の軽度、中等度、重度腎機能障害を有する2型糖尿病患者及び腎機能が正常な2型糖尿病患者における24時間累積尿糖排泄量(平均値±標準偏差、g)は、ベースラインで8.80±17.0、2.00±3.76、0.553±0.247及び6.71±8.77、投与1日目で47.2±29.9、21.2±8.86、11.9±7.27及び81.5±34.0であった6) (単回投与試験)。,,,
日本人の中等度腎機能障害(30≤eGFR<60mL/min/1.73m2)を有する2型糖尿病患者(7例)にトホグリフロジン40mg 注2) を経口投与した場合、腎機能が正常(90mL/min/1.73m2≤eGFR)な2型糖尿病患者(8例)と比較してトホグリフロジンのCmaxは1.33倍、AUCinfは1.48倍であった。また、腎機能が正常な2型糖尿病患者及び中等度腎機能障害を有する2型糖尿病患者における24時間累積尿糖排泄量(平均値±標準偏差、g)は、ベースラインで38.6±40.4及び2.46±3.17、投与1日目で138±41.7及び47.0±14.5であった7) (24週間投与試験の初回投与時)。,,注2) 本剤の承認された1回用量は20mgである。 -
16.6.2 肝機能障害患者
中等度肝機能障害患者(Child-Pugh分類Class B、9例)にトホグリフロジン40mg 注3) を単回経口投与した場合、健康成人(8例)と比較してトホグリフロジンのCmaxは1.47倍、AUCinfは1.70倍であった8) 。
注3) 本剤の承認された1回用量は20mgである。
16.7 薬物相互作用
-
16.7.1 プロベネシド
外国人の健康成人男性(15例)においてトホグリフロジン10mg 注4) (単回)にプロベネシド1,000mgを1日2回、2.5日間併用投与した場合、トホグリフロジン単独投与時に対するトホグリフロジンのCmax及びAUCinfの幾何平均の比(90%信頼区間)は1.22(1.06-1.40)及び2.33(2.22-2.44)であった9) 。
注4) 本剤の承認された1回用量は20mgである。 -
16.7.2 ケトコナゾール
外国人の健康成人男性(15例)においてトホグリフロジン10mg 注5) (単回)にケトコナゾール400mgを1日1回、5日間併用投与した場合、トホグリフロジン単独投与時に対するトホグリフロジンのCmax及びAUCinfの幾何平均の比(90%信頼区間)は1.22(1.06-1.40)及び1.26(1.20-1.32)であった9) 。
注5) 本剤の承認された1回用量は20mgである。 -
16.7.3 その他の薬剤
トホグリフロジンとグリメピリド、メトホルミン、シタグリプチン、ピオグリタゾン、ナテグリニド、ミグリトール、バルサルタン、フロセミド、アトルバスタチン又はワルファリンを併用したとき、これらの薬剤はいずれもトホグリフロジンの曝露量に影響しなかった。また、トホグリフロジンはこれらの薬剤の曝露量にほとんど影響しないことが示された10) ,11) 。トホグリフロジンとボグリボースを併用したとき、トホグリフロジンの曝露量に影響しなかった10) 。
17. 臨床成績
17.1 有効性及び安全性に関する試験
-
17.1.1 単独療法
-
(1) 国内第Ⅱ/Ⅲ相プラセボ対照二重盲検比較試験
食事療法・運動療法にて血糖コントロールが不十分な2型糖尿病患者を対象に、プラセボ、トホグリフロジン10mg、20mg又は40mg 注6) のいずれかを1日1回24週間経口投与した。24週時(最終評価時)における結果は次表のとおりであった。HbA1cの投与前からの変化量において、トホグリフロジン群はプラセボ群と比べ有意な低下が認められた。
注6) 本剤の承認された1回用量は20mgである。表 プラセボ対照二重盲検比較試験(24週時)の結果 投与群
及び
投与前
HbA1c
(NGSP) 注7)
(%)主要評価項目
副次的評価項目
HbA1c(NGSP) 注8)
(%)空腹時
血糖 注8)
(mg/dL)食後2時間
血糖 注7)
(mg/dL)投与前からの
変化量プラセボとの
差投与前からの
変化量投与前からの
変化量プラセボ
8.41±0.78
n=56-0.028±0.083
-
-8.561±2.378
-3.3±47.6
n=48トホグリフロジン10mg
8.45±0.75
n=57-0.797±0.083
-0.769*
[-1.000, -0.538]-31.868±2.358
-63.5±49.0
n=53トホグリフロジン20mg
8.34±0.81
n=58-1.017±0.082
-0.990*
[-1.220, -0.759]-35.899±2.337
-71.0±63.7
n=56トホグリフロジン40mg
8.37±0.77
n=58-0.870±0.082
-0.842*
[-1.072, -0.612]-32.327±2.337
-60.2±47.2
n=53注7) 平均値±標準偏差注8) LOCF(Last observation carried forward)法を適用した。最小二乗平均±標準誤差、[95%信頼区間]
*P<0.0001(共分散分析)また、投与前からの体重変化量(最小二乗平均±標準誤差、kg)は、プラセボ群-0.356±0.243、トホグリフロジン20mg群-2.851±0.238であり、トホグリフロジン群で体重減少が認められた。
副作用発現割合はプラセボ群で7.1%(4/56例)、トホグリフロジン10mg群で27.6%(16/58例)、20mg群で25.9%(15/58例)、40mg群で27.6%(16/58例)であった。主な副作用は、血中ケトン体増加(プラセボ群1.8%(1/56例)、10mg群3.4%(2/58例)、20mg群12.1%(7/58例)、40mg群13.8%(8/58例)、以下同様)、頻尿(1.8%(1/56例)、5.2%(3/58例)、6.9%(4/58例)、10.3%(6/58例))、尿中ケトン体陽性(0%(0/56例)、1.7%(1/58例)、5.2%(3/58例)、0%(0/58例))であった。最終評価時までの低血糖症の副作用発現割合は、プラセボ群で0%(0/56例)、トホグリフロジン10mg群で1.7%(1/58例)、20mg群で0%(0/58例)、40mg群で1.7%(1/58例)であった12) 。 -
(2) 国内第Ⅲ相長期投与試験
食事療法・運動療法にて血糖コントロールが不十分な2型糖尿病患者を対象に、トホグリフロジン20mgを1日1回52週間経口投与した。24週時及び52週時における結果は次表のとおりであり、安定した血糖コントロールが得られた。
表 単独長期投与試験の結果 投与前
HbA1c
(NGSP)
(%)投与前からの変化量
時期
HbA1c(NGSP)
(%)空腹時
血糖
(mg/dL)食後2時間
血糖
(mg/dL)7.83±0.96
n=6324週時
-0.69±0.79
n=56-32.0±36.3
n=56-57.3±49.8
n=5252週時
-0.67±0.67
n=51-23.1±26.8
n=51-59.6±55.8
n=51平均値±標準偏差
また、投与前からの体重変化量(平均値±標準偏差、kg)は24週時-2.72±1.44、52週時-3.06±2.15であり、体重減少が持続した。
副作用発現割合は39.1%(25/64例)であった。主な副作用は、血中ケトン体増加6.3%(4/64例)、頻尿12.5%(8/64例)、口渇10.9%(7/64例)であった。最終評価時までの低血糖症の副作用発現割合は、6.3%(4/64例)であった13) 。
-
(1) 国内第Ⅱ/Ⅲ相プラセボ対照二重盲検比較試験
-
17.1.2 国内第Ⅲ相経口血糖降下薬併用試験
食事療法・運動療法に加えて、経口血糖降下薬1剤の治療で血糖コントロールが不十分な2型糖尿病患者を対象に、トホグリフロジン20mgと経口血糖降下薬の2剤を52週間併用投与した。24週時及び52週時における結果は次表のとおりであった。
表 経口血糖降下薬併用試験の結果 投与群
及び
投与前HbA1c
(NGSP)(%)投与前からの変化量
時期
HbA1c(NGSP)
(%)全例
8.13±0.93
n=17224週時
-0.80±0.68
n=16252週時
-0.77±0.72
n=152スルホニルウレア剤
併用
8.24±0.82
n=3424週時
-0.83±0.68
n=3052週時
-0.70±0.60
n=29速効型インスリン
分泌促進薬併用
8.18±0.68
n=824週時
-0.62±0.38
n=652週時
-0.74±0.48
n=5ビグアナイド系薬剤
併用
7.70±0.69
n=3224週時
-0.76±0.47
n=3152週時
-0.71±0.55
n=29チアゾリジン系薬剤
併用
8.13±1.06
n=3224週時
-0.71±0.80
n=3252週時
-0.84±0.85
n=30α-グルコシダーゼ
阻害剤併用
8.14±1.06
n=3124週時
-0.89±0.73
n=2952週時
-0.84±0.72
n=27DPP-4阻害薬併用
8.38±0.95
n=3524週時
-0.83±0.73
n=3452週時
-0.78±0.88
n=32平均値±標準偏差
副作用発現割合は全例で40.6%(71/175例)であった。主な副作用は、全例で血中ケトン体増加13.1%(23/175例)、口渇7.4%(13/175例)及び頻尿5.7%(10/175例)であった。同様に、スルホニルウレア剤併用では、頻尿17.6%(6/34例)、血中ケトン体増加11.8%(4/34例)、口渇8.8%(3/34例)、便秘5.9%(2/34例)、発疹5.9%(2/34例)であり、速効型インスリン分泌促進薬併用及びビグアナイド系薬剤併用で2例以上発現した副作用は認められなかった。また、チアゾリジン系薬剤併用で血中ケトン体増加36.4%(12/33例)、尿量増加12.1%(4/33例)、口渇12.1%(4/33例)、頻尿6.1%(2/33例)、膀胱炎6.1%(2/33例)、α-グルコシダーゼ阻害剤併用で口渇6.3%(2/32例)、血中ケトン体増加6.3%(2/32例)、DPP-4阻害薬併用で血中ケトン体増加11.4%(4/35例)、尿中ケトン体陽性5.7%(2/35例)、口渇11.4%(4/35例)であった。最終評価時までの低血糖症の副作用発現割合は、トホグリフロジンとスルホニルウレア剤併用で14.7%(5/34例)、速効型インスリン分泌促進薬併用で0%(0/8例)、ビグアナイド系薬剤併用で0%(0/33例)、チアゾリジン系薬剤併用で3.0%(1/33例)、α-グルコシダーゼ阻害剤併用で0%(0/32例)、DPP-4阻害薬併用で2.9%(1/35例)であった14) 。
-
17.1.3 国内第Ⅱ相腎機能の異なる2型糖尿病患者を対象とした試験
食事療法・運動療法のみ、若しくは食事療法・運動療法に加えて経口血糖降下薬1剤の治療にもかかわらず血糖コントロールが不十分な2型糖尿病患者(腎機能正常群(90mL/min/1.73m2≤eGFR)及び中等度腎機能障害群(30≤eGFR<60mL/min/1.73m2))にトホグリフロジン40mg 注9) を1日1回24週間経口投与した。24週時における結果は次表のとおりであり、HbA1c(NGSP)の減少幅は腎機能正常群に比べて中等度腎機能障害患者では小さかった。
注9) 本剤の承認された1回用量は20mgである。表 腎機能の異なる2型糖尿病患者を対象とした試験の結果 投与群
及び
投与前HbA1c(NGSP)(%)投与前からの変化量
HbA1c(NGSP)
(%)空腹時血糖
(mg/dL)腎機能正常群(n=12)
8.23±0.779-0.68[-1.24, -0.13]
-31.9±31.4
中等度腎機能障害群(n=30)
7.63±0.984-0.24[-0.48, 0.01]
-16.3±22.0
平均値±標準偏差又は平均値[95%信頼区間]
副作用発現割合は腎機能正常群で23.1%(3/13例)、中等度腎機能障害群で13.3%(4/30例)であった。主な副作用は中等度腎機能障害群での頻尿10.0%(3/30例)であった7) 。,
17.2 製造販売後調査等
-
17.2.1 インスリン製剤併用試験
食事療法・運動療法に加えてインスリン治療(基礎インスリン製剤とDPP-4阻害薬との併用治療を含む)で血糖コントロールが不十分な2型糖尿病患者を対象に、16週間のプラセボ対照二重盲検期にプラセボ又はトホグリフロジン20mgを1日1回併用投与した結果は次表のとおりであった。
表 インスリン製剤併用プラセボ対照二重盲検比較試験(16週時)の結果 投与群及び
投与前HbA1c
(NGSP) 注10) (%)HbA1c (NGSP) 注11) (%)
投与前からの
変化量プラセボとの
差インスリン製剤
+プラセボ
8.40±0.65、n=700.48±0.089
―
インスリン製剤
+トホグリフロジン
8.53±0.76、n=140-0.59±0.069
-1.07±0.090*
[-1.246, -0.890]注10) 平均値±標準偏差注11) 調整最小二乗平均±標準誤差、[95%信頼区間]*P<0.0001
投与群、時点、投与群と時点との交互作用、スクリーニング時のHbA1c、インスリンレジメン及びeGFRを固定効果、HbA1cの投与前値、HbA1cの投与前値と時点との交互作用を共変量としたMixed Model with Repeated Measurements(MMRM)による解析16週間の二重盲検期に継続して36週間の非盲検期に移行し各群にトホグリフロジン20mgを1日1回併用投与した。投与前から52週時までのHbA1c(NGSP)の変化量(平均値±標準偏差、%)はトホグリフロジン群で-0.76±0.88であった。
低血糖症の副作用発現割合は16週間の二重盲検期のプラセボ群で15.7%(11/70例)、トホグリフロジン群で27.9%(39/140例)であった。また、トホグリフロジン群における52週間では38.6%(54/140例)であった15) 。 -
17.2.2 GLP-1受容体作動薬併用試験
食事療法・運動療法に加えてGLP-1受容体作動薬単剤治療中で血糖コントロールが不十分な2型糖尿病患者(67例)を対象に、トホグリフロジン20mgを1日1回52週間併用投与した。投与前(8.57±1.04)から52週時(LOCF法を適用)までのHbA1c(NGSP)の変化量は-0.59±0.99であった(平均値±標準偏差、%)。
最終評価時までの低血糖症の副作用発現割合は、1.5%(1/67例)であった16) 。
18. 薬効薬理
18.1 作用機序
18.2 SGLT2阻害作用
in vitroにおいて、トホグリフロジンのヒトSGLT2に対する阻害活性(Ki値: 0.0029μmol/L)は、ヒトSGLT1に対する阻害活性(Ki値: 6.0μmol/L)の2,100倍強かった。一方、主要代謝物であるカルボン酸体のSGLT2阻害活性(IC50値: 2.7μmol/L)はトホグリフロジン(IC50値: 0.0039μmol/L)の1/700と弱かった5) 。
18.3 尿糖排泄亢進作用及び血糖降下作用
-
18.3.1 2型糖尿病モデル動物
トホグリフロジンをZDFラットに単回経口投与した結果、投与後12時間までの4時間ごとの各期間のグルコース腎排泄クリアランス値は溶媒投与群と比べて有意に高値であった。また、db/dbマウスにトホグリフロジンを4週間反復経口投与した結果、糖化ヘモグロビン値が溶媒投与群に比べて有意に低下した5) 。
-
18.3.2 2型糖尿病患者(国際共同第Ⅱ相試験、日本人)
トホグリフロジン2.5、5、10、20、40mg 注12) を1日1回12週間投与した結果、最終投与日の1日累積尿糖排泄量の初回投与前からの変化量は20mg投与でほぼ最大になった。また、HbA1c及び空腹時血糖が用量依存的に低下した18) 。
注12) 本剤の承認された1回用量は20mgである。
18.4 食後過血糖改善作用
2型糖尿病モデル動物のGKラットにトホグリフロジンを単回経口投与した結果、食餌負荷による血糖値の上昇を溶媒投与群に比べて有意に抑制した5) 。
19. 有効成分に関する理化学的知見
一般的名称
トホグリフロジン水和物(Tofogliflozin Hydrate)(JAN)
化学名
(1S,3́R,4́S,5́S,6́R)-6-[(4-Ethylphenyl)methyl]-6́-(hydroxymethyl)-3́,4́,5́,6́-tetrahydro-3H-spiro[2-benzofuran-1,2́-pyran]-3́,4́,5́-triol monohydrate
分子式
C22H26O6・H2O
分子量
404.45
性状
白色の粉末で、吸湿性はない。N,N-ジメチルアセトアミド、メタノール又はエタノール(99.5)に極めて溶けやすく、水に溶けにくい。
化学構造式
![]()
融点
71~92℃
22. 包装
PTP: 100錠(10錠×10)、140錠(14錠×10)、500錠(10錠×50)、700錠(14錠×50)
バラ: 500錠(プラスチックボトル)
23. 主要文献
1) 興和(株)社内資料: 第Ⅰ相 食事の影響試験(2014年3月24日承認、CTD2.7.6.1.1)
2) 興和(株)社内資料: 第Ⅰ相 反復投与試験(2014年3月24日承認、CTD2.7.6.1.3)
3) 興和(株)社内資料: 第Ⅰ相 マスバランス試験(海外)(2014年3月24日承認、CTD2.7.6.2.1、2.7.2.2.2.4)
4) 興和(株)社内資料: 非臨床試験 薬物動態試験(2014年3月24日承認、CTD2.6.4.1-11)
5) 興和(株)社内資料: 非臨床試験 薬理試験(2014年3月24日承認、CTD2.6.2.1-8)
6) 興和(株)社内資料: 第Ⅰ相 腎機能障害を有する2型糖尿病患者を対象とした単回投与試験(海外)(2014年3月24日承認、CTD2.7.6.2.4)
7) 興和(株)社内資料: 第Ⅱ相 腎機能の異なる2型糖尿病患者対象24週間投与試験(2014年3月24日承認、CTD2.7.6.1.10)
8) 興和(株)社内資料: 第Ⅰ相 肝機能障害患者を対象とした単回投与試験(2014年3月24日承認、CTD2.7.6.1.4)
9) 興和(株)社内資料: 第Ⅰ相 薬物相互作用試験(海外)(2014年3月24日承認、CTD2.7.6.2.5)
10) 興和(株)社内資料: 第Ⅰ相 薬物相互作用試験(1)(2014年3月24日承認、CTD2.7.6.1.5)
11) 興和(株)社内資料: 第Ⅰ相 薬物相互作用試験(2)(2014年3月24日承認、CTD2.7.6.1.6)
12) 興和(株)社内資料: 第Ⅱ/Ⅲ相 単独療法プラセボ対照二重盲検比較試験(2014年3月24日承認、CTD2.7.6.1.7)
13) 興和(株)社内資料: 第Ⅲ相 単独療法長期投与試験(2014年3月24日承認、CTD2.7.6.1.8)
14) 興和(株)社内資料: 第Ⅲ相 併用療法長期投与試験-経口血糖降下薬併用試験(2014年3月24日承認、CTD2.7.6.1.9)
15) 興和(株)社内資料: 製造販売後臨床試験-インスリン製剤併用試験
16) 興和(株)社内資料: 製造販売後臨床試験-GLP-1受容体作動薬併用試験
17) Chao EC, et al.: Nat Rev Drug Discov. 2010; 9: 551-9.
18) 興和(株)社内資料:第Ⅱ相 2型糖尿病患者を対象とした用量設定のための国際共同試験(2014年3月24日承認、CTD2.7.6.3.1)
24. 文献請求先及び問い合わせ先
興和株式会社 くすり相談センター
〒103-8433 東京都中央区日本橋本町三丁目4-14
電話 0120-508-514
03-3279-7587
受付時間 9:00~17:00(土・日・祝日・弊社休日を除く)
26. 製造販売業者等
26.1 製造販売元
興和株式会社
東京都中央区日本橋本町三丁目4-14