マイザー軟膏0.05%/マイザークリーム0.05%
作成又は改訂年月
| 2020年 10月改訂 ( 第1版 ) |
日本標準商品分類番号
薬効分類名
承認等
一般的名称
4. 効能又は効果
湿疹・皮膚炎群(進行性指掌角皮症、ビダール苔癬、脂漏性皮膚炎、放射線皮膚炎、日光皮膚炎を含む)、痒疹群(蕁麻疹様苔癬、ストロフルス、固定蕁麻疹、結節性痒疹を含む)、虫さされ、乾癬、掌蹠膿疱症、扁平紅色苔癬、ジベルばら色粃糠疹、薬疹・中毒疹、慢性円板状エリテマトーデス、紅斑症(多形滲出性紅斑、ダリエ遠心性環状紅斑、遠心性丘疹性紅斑)、特発性色素性紫斑(マヨッキー紫斑、シャンバーク病、紫斑性色素性苔癬様皮膚炎)、紅皮症、肉芽腫症(サルコイドーシス、環状肉芽腫)、円形脱毛症、アミロイド苔癬(斑状アミロイドーシスを含む)、肥厚性瘢痕・ケロイド
5. 効能又は効果に関連する注意
6. 用法及び用量
通常1日1~数回適量を患部に塗布する。
なお、症状により適宜増減する。
8. 重要な基本的注意
9. 特定の背景を有する患者に関する注意
11. 副作用
11.1 重大な副作用
11.2 その他の副作用
|
0.1~5%未満 |
0.1%未満 |
頻度不明 |
|
|---|---|---|---|
|
皮膚の感染症 注1) |
細菌感染症(毛嚢炎等) |
細菌感染症(伝染性膿痂疹) |
皮膚の真菌症(カンジダ症、白癬等)、ウイルス感染症 |
|
その他の皮膚症状 |
軟毛の濃色化 注2) |
色素脱失 注2) |
|
|
過敏症 |
接触皮膚炎 |
紅斑 |
|
|
内分泌系 |
下垂体・副腎皮質系機能の抑制 注3) |
16. 薬物動態
16.3 分布
16.4 代謝
ラットではジフルプレドナートは経皮吸収された後、表皮及び真皮内で21位のアセテートが加水分解され、体循環に入り、次いで17位のブチレートが加水分解されると考えられる3) 。
17. 臨床成績
17.1 有効性及び安全性に関する試験
-
17.1.1 国内臨床試験
承認時及び効能・効果の追加承認時における有効性評価対象症例は1,789例であり、有効率は軟膏が89.3%(856例/959例)、クリームが88.8%(737例/830例)であった4) ,5) ,6) ,7) ,8) ,9) ,10) ,11) ,12) ,13) ,14) 。
疾患名
有効率(%)[かなり軽快以上]
軟膏
クリーム
湿疹・皮膚炎群
96.8(182例/188例)
94.7(177例/187例)
脂漏性皮膚炎
96.7(29例/30例)
92.9(26例/28例)
放射線皮膚炎
88.0(22例/25例)
91.3(21例/23例)
日光皮膚炎
89.7(26例/29例)
97.1(33例/34例)
痒疹群
84.9(45例/53例)
94.1(48例/51例)
虫さされ
100.0(27例/27例)
100.0(30例/30例)
乾癬
87.9(189例/215例)
77.6(83例/107例)
掌蹠膿疱症
87.9(29例/33例)
86.2(25例/29例)
扁平紅色苔癬
92.0(23例/25例)
100.0(23例/23例)
ジベルばら色粃糠疹
85.5(47例/55例)
87.5(42例/48例)
薬疹・中毒疹
100.0(27例/27例)
96.3(26例/27例)
慢性円板状エリテマトーデス
91.7(22例/24例)
93.3(28例/30例)
紅斑症
96.3(26例/27例)
100.0(30例/30例)
特発性色素性紫斑
93.5(29例/31例)
93.9(31例/33例)
紅皮症
95.6(43例/45例)
93.2(41例/44例)
肉芽腫症
92.9(13例/14例)
76.9(10例/13例)
円形脱毛症
56.0(14例/25例)
67.9(19例/28例)
アミロイド苔癬
(斑状アミロイドーシスを含む)73.1(19例/26例)
72.2(13例/18例)
肥厚性瘢痕・ケロイド
62.8(27例/43例)
59.0(23例/39例)
その他
100.0(17例/17例)
100.0(8例/8例)
副作用発現頻度は、軟膏が3.60%(37例/1029例)、クリームが4.50%(41例/911例)であった。主な副作用は、軟膏が毛嚢炎・せつ1.75%(18例/1029例)、ざ瘡様発疹0.97%(10例/1029例)、クリームが毛嚢炎・せつ1.43%(13例/911例)、ざ瘡様発疹0.77%(7例/911例)などのいずれも感染性のものであった。
18. 薬効薬理
18.1 作用機序
コルチコステロイドは、標的細胞の細胞質内に入り、そこに存在するレセプターと結合後、核内に移行して遺伝子を活性化し、合成されたメッセンジャーRNAが細胞質内に特異的蛋白リポコルチン合成する。
細胞膜を形成するリン脂質に含まれるアラキドン酸は、ホスホリパーゼA2(PLA2)により遊離後、代謝を受けて各種のプロスタグランジン、トロンボキサン、ロイコトリエンとなり炎症に関与するが、リポコルチンはこのPLA2を阻害することにより、抗炎症作用を発現するものと考えられている15)
。
18.2 血管収縮作用(健康成人)
18.3 抗炎症作用(ラット)
18.4 抗アレルギー作用(マウス)
19. 有効成分に関する理化学的知見
一般的名称
ジフルプレドナート(Difluprednate)
化学名
6α, 9-Difluoro-11β, 17, 21-trihydroxy-1, 4-pregnadiene-3, 20-dione 21-acetate 17-butyrate
分子式
C27H34F2O7
分子量
508.55
性状
白色~微黄白色の結晶又は結晶性の粉末である。
アセトニトリルに溶けやすく、エタノール(95)又は1, 4-ジオキサンにやや溶けやすく、水にほとんど溶けない。
化学構造式
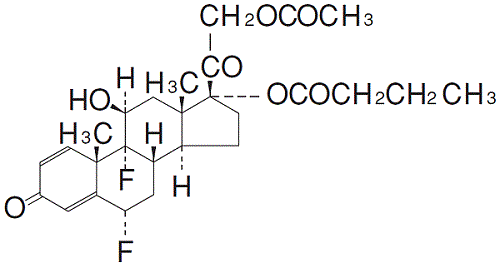
融点
約190℃(分解)
22. 包装
23. 主要文献
1) 藤野明治, 他: 応用薬理. 1985; 29(5): 687-699
2) 藤野明治, 他: 応用薬理. 1985; 29(5): 701-712
3) 藤野明治, 他: 応用薬理. 1985; 29(5): 713-723
4) 渡辺 靖, 他: 薬理と治療. 1985; 13(8): 4663-4679
5) 久木田淳, 他: 西日本皮膚科. 1986; 48(1): 119-135
6) 久木田淳, 他: 皮膚. 1985; 27(5): 1067-1076
7) 久木田淳, 他: 皮膚. 1985; 27(5): 1052-1066
8) 久木田淳, 他: 薬理と治療. 1985; 13(8): 4681-4692
9) 斉藤胤曠, 他: 薬理と治療. 1985; 13(8): 4693-4703
10) 新村眞人, 他: 臨床医薬. 1990; 6(5): 1027-1037
11) 竹村 司: 基礎と臨床. 1990; 24(4): 2147-2155
12) 牧野久美, 他: 基礎と臨床. 1990; 24(4): 2112-2115
13) 三島 豊, 他: 基礎と臨床. 1990; 24(3): 1491-1497
14) 広根孝衛, 他: 基礎と臨床. 1990; 24(5): 2931-2935
15) 鹿取 信: 炎症とプロスタグランジン. 1986; 74-93
16) 石原 勝: 皮膚科紀要. 1985; 80(4): 359-366
17) 渡辺 靖: 西日本皮膚科. 1985; 47(6): 1105-1111
24. 文献請求先及び問い合わせ先
田辺三菱製薬株式会社 くすり相談センター
〒541-8505 大阪市中央区道修町3-2-10
電話 0120-753-280
26. 製造販売業者等
26.1 製造販売元
田辺三菱製薬株式会社
大阪市中央区道修町3-2-10