デルモベート軟膏0.05%/デルモベートクリーム0.05%
作成又は改訂年月
| 2020年 12月改訂 ( 第1版 ) |
日本標準商品分類番号
薬効分類名
一般的名称
4. 効能又は効果
5. 効能又は効果に関連する注意
皮膚感染を伴う湿疹・皮膚炎には使用しないことを原則とするが、やむを得ず使用する必要がある場合には、あらかじめ適切な抗菌剤(全身適用)、抗真菌剤による治療を行うか、又はこれらとの併用を考慮すること。
6. 用法及び用量
通常1日1~数回適量を塗布する。なお、症状により適宜増減する。
8. 重要な基本的注意
9. 特定の背景を有する患者に関する注意
9.5 妊婦
妊婦又は妊娠している可能性のある女性には、治療上の有益性が危険性を上回ると判断される場合にのみ使用すること。使用する必要がある場合には、大量又は長期にわたる広範囲の使用を避けること。動物実験(ラット)で催奇形作用が報告されている1) 。
11. 副作用
11.1 重大な副作用
11.2 その他の副作用
|
頻度不明 |
|
|---|---|
|
皮膚の感染症注1) |
真菌症(カンジダ症、白癬等)、細菌感染症(伝染性膿痂疹、毛のう炎等)、ウイルス感染症 |
|
過敏症注2) |
紅斑、発疹、蕁麻疹、そう痒、皮膚灼熱感、接触性皮膚炎 |
|
その他の皮膚症状 |
ステロイド皮膚注3)(皮膚萎縮、毛細血管拡張、紫斑)、色素脱失注3)、酒さ様皮膚炎・口囲皮膚炎注3)(ほほ、口囲等に潮紅、丘疹、膿疱、毛細血管拡張)、多毛注3)、ステロイドざ瘡、魚鱗癬様皮膚変化、一過性の刺激感、乾燥 |
|
その他 |
下垂体・副腎皮質系機能抑制注4)、中心性漿液性網脈絡膜症 |
注2)これらの症状は原疾患の症状に類似している場合がある。
注3)長期連用によりあらわれることがある。このような症状があらわれた場合には徐々にその使用を差し控え、副腎皮質ステロイドを含有しない薬剤に切り替えること。
注4)大量又は長期にわたる広範囲の使用、密封法(ODT)によりあらわれることがある。また、このような場合において、使用中止により急性副腎皮質機能不全に陥る危険性があるため、使用を中止する際は患者の状態を観察しながら徐々に減量すること。
15. その他の注意
15.1 臨床使用に基づく情報
乾癬患者に長期大量使用した場合、治療中あるいは治療中止後、乾癬性紅皮症、膿疱性乾癬等がみられたとの報告がある2) 。
16. 薬物動態
16.1 血中濃度
ラットに3H-クロベタゾールプロピオン酸エステル0.15%含有軟膏、クリーム及び0.05%外用液を経皮投与した結果、いずれも血中濃度は投与後8時間まで上昇した後、その後96時間まではほぼ一定もしくは非常にゆるやかに減少した。
16.2 吸収
切除目的の腋臭症患者の腋窩皮膚に3H-クロベタゾールプロピオン酸エステル0.05%含有クリームを塗布(密封法(ODT))した後、オートラジオグラフィー法で表皮への取り込みを経時的に観察した結果、塗布後30分で既に表皮に取り込まれ、塗布後5時間で定常状態となり、この状態は塗布後24時間まで持続した。また外用剤除去24時間後も表皮内に貯留していた3) 。
16.3 分布
ラットに3H-クロベタゾールプロピオン酸エステル0.15%含有軟膏、クリーム及び0.05%外用液を経皮投与した結果、96時間後の体内残存量(塗布部を除く)はそれぞれ0.42%、0.96%及び2.85%であり、特定の組織への親和性は示さないものの脾臓中濃度において若干高い傾向が認められた。
16.5 排泄
ラットに3H-クロベタゾールプロピオン酸エステル0.15%含有軟膏、クリーム及び0.05%外用液を経皮投与した場合の主排泄経路は糞中排泄であり、投与後96時間までの糞中及び尿中排泄率の合計はそれぞれ1.22%、9.20%及び8.86%であった。
17. 臨床成績
17.1 有効性及び安全性に関する試験
-
〈湿疹・皮膚炎群(進行性指掌角皮症、ビダール苔癬、日光皮膚炎を含む)、痒疹群(蕁麻疹様苔癬、ストロフルス、固定蕁麻疹を含む)、掌蹠膿疱症、乾癬〉
-
17.1.1 国内第Ⅲ相試験
二重盲検比較試験を含む臨床試験において、湿疹・皮膚炎群、痒疹群、掌蹠膿疱症又は乾癬を有する成人及び小児患者総症例1206例に本剤を1日1~数回患部に塗布した時の有効率は下表のとおりであった。なお、症例の約89%が単純塗布であった4) ,5) ,6) ,7) ,8) ,9) ,10) 。
疾患名
使用期間
(日)有効率%(有効症例数/症例数)
軟膏
クリーム
合計
湿疹・皮膚炎群注1)
2~56
95.4
(377/395)96.7
(321/332)96.0
(698/727)痒疹群注2)
5~35
81.3
(26/32)80.5
(33/41)80.8
(59/73)掌蹠膿疱症
5~56
90.4
(47/52)92.6
(50/54)91.5
(97/106)乾癬
2~35
98.7
(147/149)95.4
(144/151)97.0
(291/300)注1)進行性指掌角皮症、ビダール苔癬、日光皮膚炎を含む。
注2)蕁麻疹様苔癬、ストロフルス、固定蕁麻疹を含む。
-
17.1.1 国内第Ⅲ相試験
-
〈虫さされ、薬疹・中毒疹、ジベルばら色粃糠疹、慢性円板状エリテマトーデス、扁平紅色苔癬、紅皮症、肥厚性瘢痕・ケロイド、肉芽腫症(サルコイドーシス、環状肉芽腫)、アミロイド苔癬、天疱瘡群、類天疱瘡(ジューリング疱疹状皮膚炎を含む)、悪性リンパ腫(菌状息肉症を含む)、円形脱毛症(悪性を含む)〉
-
17.1.2 国内第Ⅲ相試験
難治性慢性皮膚疾患等のいずれかを有する患者557例に対する非盲検試験において、本剤を1日1~数回患部に塗布した時の有効率は下表のとおりであった11) 。
疾患名
使用期間
(日)有効率%(有効症例数/症例数)
軟膏
クリーム
合計
虫さされ
2~24
100.0
(20/20)100.0
(20/20)100.0
(40/40)薬疹・中毒疹
100.0
(21/21)92.9
(26/28)95.9
(47/49)ジベルばら色粃糠疹
100.0
(20/20)95.5
(21/22)97.6
(41/42)慢性円板状
エリテマトーデス14~56
95.2
(20/21)81.8
(18/22)88.4
(38/43)扁平紅色苔癬
95.8
(23/24)87.0
(20/23)91.5
(43/47)紅皮症
96.7
(29/30)90.0
(18/20)94.0
(47/50)肥厚性瘢痕・ケロイド
65.3
(32/49)61.9
(26/42)63.7
(58/91)肉芽腫症
(サルコイドーシス、環状肉芽腫)81.3
(13/16)84.2
(16/19)82.9
(29/35)アミロイド苔癬
93.8
(15/16)100.0
(16/16)96.9
(31/32)天疱瘡群
100.0
(14/14)80.0
(8/10)91.7
(22/24)類天疱瘡
(ジューリング疱疹状皮膚炎を含む)92.3
(12/13)100.0
(8/8)95.2
(20/21)悪性リンパ腫
(菌状息肉症を含む)71.4
(10/14)100.0
(7/7)81.0
(17/21)円形脱毛症
(悪性を含む)21~63
73.1
(19/26)75.8
(25/33)74.6
(44/59)副作用発現頻度は、クリームで14.7%(40/273例)、軟膏で13.0%(37/284例)であった。主な副作用は、皮膚萎縮24件、毛細血管拡張24件、毛包炎・癤16件、痤瘡様疹16件であった。
-
17.1.2 国内第Ⅲ相試験
18. 薬効薬理
18.1 作用機序
クロベタゾールプロピオン酸エステルは合成コルチコステロイドの一種であり、炎症性サイトカイン産生の抑制及びアラキドン酸代謝の阻害等のメカニズムを介して抗炎症作用を示すと考えられる。
18.2 血管収縮作用
クロベタゾールプロピオン酸エステルはMcKenzieらの方法による健康成人皮膚における血管収縮試験(皮膚蒼白度を指標)においてフルオシノロンアセトニドの約18.7倍、ベタメタゾン吉草酸エステルの約5.2倍の血管収縮作用を示した12) 。
18.3 肉芽腫抑制作用
クロベタゾールプロピオン酸エステルは副腎摘出ラットにおける綿球肉芽腫抑制試験においてヒドロコルチゾンの112.5倍、ベタメタゾン吉草酸エステルの約2.4倍の肉芽腫抑制作用を示した13) 。
18.4 浮腫抑制作用
クロベタゾールプロピオン酸エステルはラットにおけるホルマリン浮腫及びカラゲニン浮腫抑制試験においてヒドロコルチゾンの約36~161倍、ベタメタゾン吉草酸エステルの約2~4倍の浮腫抑制作用を示した13) 。
18.5 皮膚局所への影響
クロベタゾールプロピオン酸エステル0.05%含有軟膏及びクリームのラットにおける塗布部位の皮膚萎縮に及ぼす影響は、0.025%フルオシノロンアセトニドより軽度であった14) 。
18.6 全身への影響
クロベタゾールプロピオン酸エステル0.05%含有軟膏及びクリームを成長期のラットの背部皮膚に塗布した結果、胸腺萎縮作用及び体重増加抑制に及ぼす影響は0.025%フルオシノロンアセトニドより軽度であった14) 。
19. 有効成分に関する理化学的知見
一般的名称
クロベタゾールプロピオン酸エステル(Clobetasol Propionate)
化学名
21-Chloro-9-fluoro-11β,17-dihydroxy-16β-methylpregna-1,4-diene-3,20-dione 17-propanoate
分子式
C25H32ClFO5
分子量
466.97
性状
白色~微黄白色の結晶性の粉末である。メタノール又はエタノール(99.5)にやや溶けやすく、水にほとんど溶けない。
化学構造式
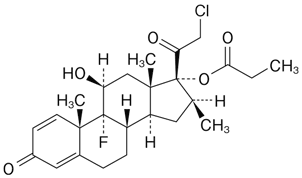
融点
約196℃(分解)
分配係数(logP)
3.8(pH7.1、1-オクタノール/水系)
23. 主要文献
1) 倉本昌明ほか:基礎と臨床.1975;9:3259-3283
2) Tan RS-H:Proc R Soc Med.1974;67:719-720
3) 竹田勇士ほか:西日本皮膚科.1975;37:796-801
4) Clobetasol 17-Propionate 外用剤臨床研究班:臨床評価.1976;4:507-548
5) 須貝哲郎:西日本皮膚科.1975;37:633-639
6) 渡辺 靖:西日本皮膚科.1975;37:622-632
7) 外松茂太郎ほか:西日本皮膚科.1976;38:111-118
8) 阿曽三樹ほか:西日本皮膚科.1975;37:553-564
9) 安里哲時ほか:西日本皮膚科.1975;37:565-572
10) 木村秀人ほか:西日本皮膚科.1975;37:640-643
11) Clobetasol 17-Propionate 外用剤難治性皮膚疾患研究班:西日本皮膚科.1982;44:677-689
12) Munro DD,et al.:Br Med J.1975;3:626-628
24. 文献請求先及び問い合わせ先
グラクソ・スミスクライン株式会社
東京都港区赤坂1-8-1
カスタマー・ケア・センター
TEL:0120-561-007(9:00~17:45/土日祝日及び当社休業日を除く)
FAX:0120-561-047(24時間受付)
26. 製造販売業者等
26.1 製造販売元
グラクソ・スミスクライン株式会社
東京都港区赤坂1-8-1
http://jp.gsk.com