ウテメリン注50mg
作成又は改訂年月
| ** | 2022年 1月改訂 ( 第3版 ) |
| * | 2021年 3月改訂 ( 第2版 ) |
日本標準商品分類番号
薬効分類名
承認等
ウテメリン注50mg
販売名コード
YJコード
販売名英語表記
販売名ひらがな
承認番号等
承認番号
販売開始年月
貯法・有効期間
貯法
有効期間
規制区分
劇薬
処方箋医薬品 注)
注) 注意―医師等の処方箋により使用すること一般的名称
2. 禁忌(次の患者には投与しないこと)
- 2.1 強度の子宮出血、子癇、前期破水例のうち子宮内感染を合併する症例、常位胎盤早期剥離、子宮内胎児死亡、その他妊娠の継続が危険と判断される患者[妊娠継続が危険と判断される。]
- 2.2 重篤な甲状腺機能亢進症の患者[症状が増悪するおそれがある。]
- 2.3 重篤な高血圧症の患者[過度の昇圧が起こるおそれがある。]
- 2.4 重篤な心疾患の患者[心拍数増加等により症状が増悪するおそれがある。]
- 2.5 重篤な糖尿病の患者[過度の血糖上昇が起こるおそれがある。また、糖尿病性ケトアシドーシスがあらわれることもある。],
- 2.6 重篤な肺高血圧症の患者[肺水腫が起こるおそれがある。]
- 2.7 妊娠16週未満の妊婦
- 2.8 本剤の成分に対し重篤な過敏症の既往歴のある患者
3. 組成・性状
4. 効能又は効果
緊急に治療を必要とする切迫流・早産
5. 効能又は効果に関連する注意
6. 用法及び用量
通常、1アンプル(5mL)を5%ブドウ糖注射液または10%マルトース注射液500mLに希釈し、リトドリン塩酸塩として毎分50μgから点滴静注を開始し、子宮収縮抑制状況および母体心拍数などを観察しながら適宜増減する。子宮収縮の抑制後は症状を観察しながら漸次減量し、毎分50μg以下の速度を維持して収縮の再発が見られないことが確認された場合には投与を中止すること。
通常、有効用量は毎分50~150μgである。なお、注入薬量は毎分200μgを越えないようにすること。
8. 重要な基本的注意
- 8.1 肺水腫は心疾患、妊娠高血圧症候群の合併、多胎妊娠、副腎皮質ホルモン剤併用時等に発生しやすいとの報告があるので、これらの患者には、水分の過負荷を避け、十分な観察を行うこと。水分の過負荷を避けるには、薬剤濃度を上げて注入液量を減らすことが効果的である。シリンジポンプを使用することにより、薬剤濃度を3mg/mL(全50mL中リトドリン塩酸塩150mg)まで上げることができる。この場合、注入速度1mL/hrで毎分50μgの初期注入薬量が得られ、水分の負荷は通常用法(液量500mL中リトドリン塩酸塩50mg)の1/30となる。,,,,,,
- 8.2 本剤投与直後に帝王切開術を行うと、循環動態の大きな変動により心不全があらわれることがある。休薬期間をおくことが望ましいが、やむを得ず投与直後に帝王切開術を行う場合には、観察を十分に行い、異常が認められた場合には、適切な処置を行うこと。
- 8.3 本剤継続投与によって、白血球減少又は無顆粒球症があらわれることがあるので、定期的に血液検査を行うとともに観察を十分に行い、発熱、咽頭痛等の異常があらわれた場合には直ちに投与を中止し、適切な処置を行うこと。なお、白血球減少及び無顆粒球症はほとんどが2-3週間以上の継続投与例において発現しているので、特に注意すること。
- 8.4 本剤投与中、血糖値の急激な上昇や糖尿病の悪化から、糖尿病性ケトアシドーシスがあらわれることがある。投与前から口渇、多飲、多尿、頻尿等の糖尿病症状の有無や血糖値、尿糖、尿ケトン体等の観察を十分に行うこと。,,
- 8.5 子宮収縮の状態及び母体心拍数・血圧、胎児心拍数を含む心血管系への作用の監視を行いながら投与し、投与中に過度の心拍数増加(頻脈)、血圧低下があらわれた場合には、注入速度を遅らせ、減量するなど適切な処置を行うこと。
- 8.6 *本剤を投与した母体から出生した早産児において、低血糖のリスクが高いことが報告されている1) ので、症状の有無にかかわらず新生児の血糖値のモニタリングを適切に行い、異常が認められた場合には、適切な処置を行うこと。
- 8.7 *本剤と硫酸マグネシウム水和物(注射剤)を併用した母体から出生した早産児において、高カリウム血症のリスクが高いことが報告されている1) ので、これらを併用した場合には、症状の有無にかかわらず新生児の心電図又は血清カリウム値のモニタリングを適切に行い、異常が認められた場合には、適切な処置を行うこと。,
- 8.8 注入薬量毎分200μgを越えて投与する場合、副作用発現の可能性が増大するので注意すること。
9. 特定の背景を有する患者に関する注意
9.1 合併症・既往歴等のある患者
-
9.1.1 甲状腺機能亢進症の患者(重篤な甲状腺機能亢進症の患者を除く)
症状が増悪するおそれがある。
-
9.1.2 高血圧症の患者(重篤な高血圧症の患者を除く)
過度の昇圧が起こるおそれがある。
- 9.1.3 心疾患の患者(重篤な心疾患の患者を除く)
- 9.1.4 糖尿病の患者(重篤な糖尿病の患者を除く)、糖尿病の家族歴、高血糖あるいは肥満等の糖尿病の危険因子を有する患者
- 9.1.5 肺高血圧症の患者(重篤な肺高血圧症の患者を除く)
- 9.1.6 筋緊張性(強直性)ジストロフィー等の筋疾患又はその既往歴のある患者
- 9.1.7 妊娠高血圧症候群の患者
- 9.1.8 本剤の成分に対し過敏症の既往歴のある患者(重篤な過敏症の既往歴のある患者を除く)
9.5 妊婦
9.6 授乳婦
出産直前に本剤を投与した場合には、母乳栄養の有益性を考慮し、出産直後の授乳を検討すること。動物実験(ラット)で乳汁中への移行が報告されている。
10. 相互作用
11. 副作用
11.1 重大な副作用
-
11.1.1 肺水腫、心不全(頻度不明)
肺水腫があらわれることがあり、急性心不全の合併に至った例もあるので、呼吸困難、胸部圧迫感、咳嗽、頻脈、低酸素血症等に十分注意すること。また、肺水腫に合併しない心不全があらわれることもあり、帝王切開術後に心不全に至った症例が報告されているので、帝王切開術後も十分観察を行うこと。,,,,,,,,
- 11.1.2 汎血球減少、無顆粒球症、白血球減少、血小板減少(頻度不明)
-
11.1.3 ショック(頻度不明)
ショック(蒼白、チアノーゼ、血圧低下等)があらわれることがある。
- 11.1.4 不整脈(頻度不明)
-
11.1.5 肝機能障害、黄疸(頻度不明)
AST、ALTの上昇等の肝機能障害、黄疸があらわれることがある。
-
11.1.6 中毒性表皮壊死融解症(Toxic Epidermal Necrolysis:TEN)、皮膚粘膜眼症候群(Stevens-Johnson症候群)(頻度不明)
発熱、紅斑、そう痒感、眼充血、口内炎等の症状が認められた場合には、適切な処置を行うこと。
- 11.1.7 横紋筋融解症(頻度不明)
- 11.1.8 血清カリウム値の低下(頻度不明)
- 11.1.9 胸水(頻度不明)
-
11.1.10 高血糖、糖尿病性ケトアシドーシス(頻度不明)
血糖値の急激な上昇や糖尿病の悪化から、糖尿病性ケトアシドーシスがあらわれることがある。糖尿病性ケトアシドーシスに至ると母体と胎児の生命を脅かすことがある。,,
- 11.1.11 腸閉塞(頻度不明)
- 11.1.12 新生児腸閉塞(頻度不明)
-
11.1.13 胎児及び新生児における心不全(頻度不明)
胎児及び新生児に心不全があらわれることがあり、特に2週間以上の投与例で心不全を認めた報告がある。胎児期から心拡大等の心不全徴候に留意すること。
- 11.1.14 可逆的な新生児心室中隔壁の肥大(頻度不明)
- 11.1.15 *新生児低血糖(頻度不明)
- 11.1.16 *新生児高カリウム血症(頻度不明)
11.2 その他の副作用
|
5%以上 |
0.1~5%未満 |
頻度不明 |
|
|---|---|---|---|
|
循環器 注1) |
動悸・頻脈 |
顔面潮紅、顔面疼痛 |
心電図異常(ST・Tの異常)、上室性頻拍、血圧の変動、息苦しさ、胸痛 |
|
肝臓 |
肝機能障害(AST、ALTの上昇等) | ||
|
血液 |
血小板減少、貧血 |
||
|
精神神経系 |
振戦、頭痛、四肢末梢熱感、脱力感、発汗、眩暈 |
しびれ感 |
|
|
**消化器 |
嘔気、嘔吐、便秘 |
下痢 |
|
|
過敏症 |
発疹 |
多形滲出性紅斑、腫脹、そう痒 |
|
|
投与部位 |
血管痛、静脈炎 | ||
|
**その他 |
尿糖の変動、発熱、冷汗 |
唾液腺腫脹、高アミラーゼ血症(唾液腺型アミラーゼ増加)、一過性の血糖上昇、CK上昇、倦怠感、こわばり、咳嗽 |
|
|
*胎児・新生児 |
胎児頻脈、胎児不整脈、新生児頻脈、新生児腎機能障害、新生児呼吸障害(多呼吸等) |
14. 適用上の注意
16. 薬物動態
16.1 血中濃度
16.5 排泄
本剤を健康成人に注入薬量100μg/分で1時間点滴静注した際 注2) 、投与開始から48時間以内に投与量の50%が尿中に排泄され、そのほとんどは12時間以内に排泄された3) 。
18. 薬効薬理
19. 有効成分に関する理化学的知見
一般的名称
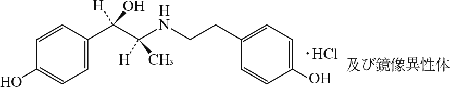
リトドリン塩酸塩(Ritodrine Hydrochloride)(JAN)
化学名
(1RS, 2SR)-1-(4-Hydroxyphenyl)-2-{[2-(4-hydroxyphenyl)ethyl]amino}propan-1-ol monohydrochloride
分子式
C17H21NO3・HCl
分子量
323.81
性状
本品は白色の結晶性の粉末である。本品は水、メタノール又はエタノール(99.5)に溶けやすい。本品は0.01mol/L塩酸試液に溶ける。本品の水溶液(1→10)は旋光性を示さない。本品は光により徐々に淡黄色となる。
化学構造式
融点
約196℃(分解)
22. 包装
10アンプル、50アンプル
23. 主要文献
1) *Yada Y, et al.: Scientific Reports.2020;10(1): 7804[文献参照番号][89292]
2) Ferguson, J. E. II, et al.: Am. J. Obstet. Gynecol.1984;148(2): 166-171[文献参照番号][12450]
3) 社内資料: 健康成人を対象とした第I相臨床試験[文献参照番号][79151]
4) 坂元正一ほか: 医学のあゆみ.1985; 133(8): 558-571[文献参照番号][11813]
6) 坂元正一ほか: 産科と婦人科.1991; 58(11): 2263-2284[文献参照番号][11627]
8) 池田滋ほか: Japan. J. Pharmacol.1984; 36(4): 477-484[文献参照番号][11857]
9) 和泉秀隆ほか: Br. J. Pharmacol.1982; 76(3): 463-471[文献参照番号][12505]
10) 池田滋ほか: Japan. J. Pharmacol.1984; 35(3): 319-326[文献参照番号][11867]
11) 池田滋ほか: 日本産科婦人科学会雑誌.1983; 35(11): 1963-1971[文献参照番号][11873]
12) 藤本征一郎ほか: Asia-Oceania. J. Obstet. Gynaecol.1983; 9(3): 325-333[文献参照番号][11868]
24. 文献請求先及び問い合わせ先
キッセイ薬品工業株式会社 くすり相談センター
〒112-0002 東京都文京区小石川3丁目1番3号
フリーダイヤル:0120-007-622
26. 製造販売業者等
26.1 製造販売元
キッセイ薬品工業株式会社
長野県松本市芳野19番48号