ソリフェナシンコハク酸塩OD錠2.5mg「日医工」/ソリフェナシンコハク酸塩OD錠5mg「日医工」
作成又は改訂年月
| 2021年 2月作成 ( 第1版 ) |
日本標準商品分類番号
薬効分類名
承認等
ソリフェナシンコハク酸塩OD錠2.5mg「日医工」
販売名コード
YJコード
販売名英語表記
販売名ひらがな
承認番号等
承認番号
販売開始年月
貯法・有効期間
貯法
有効期間
規制区分
処方箋医薬品 注)
注) 注意―医師等の処方箋により使用することソリフェナシンコハク酸塩OD錠5mg「日医工」
販売名コード
YJコード
販売名英語表記
販売名ひらがな
承認番号等
承認番号
販売開始年月
貯法・有効期間
貯法
有効期間
規制区分
処方箋医薬品 注)
注) 注意―医師等の処方箋により使用すること一般的名称
2. 禁忌(次の患者には投与しないこと)
- 2.1 本剤の成分に対し過敏症の既往歴のある患者
- 2.2 尿閉を有する患者[排尿時の膀胱収縮が抑制され、症状が悪化するおそれがある。]
- 2.3 閉塞隅角緑内障の患者[抗コリン作用により眼圧が上昇し、症状が悪化するおそれがある。]
- 2.4 幽門部、十二指腸又は腸管が閉塞している患者及び麻痺性イレウスのある患者[胃腸の平滑筋の収縮及び運動が抑制され、症状が悪化するおそれがある。]
- 2.5 胃アトニー又は腸アトニーのある患者[抗コリン作用により消化管運動が低下するため症状が悪化するおそれがある。]
- 2.6 重症筋無力症の患者[抗コリン作用により筋緊張の低下がみられ症状が悪化するおそれがある。]
- 2.7 重篤な心疾患の患者[期外収縮等の心電図異常が報告されており、症状が悪化するおそれがある。],
- 2.8 重度の肝機能障害患者(Child-Pugh分類C)
4. 効能又は効果
過活動膀胱における尿意切迫感、頻尿及び切迫性尿失禁
5. 効能又は効果に関連する注意
6. 用法及び用量
通常、成人にはコハク酸ソリフェナシンとして5mgを1日1回経口投与する。
なお、年齢、症状により適宜増減するが、1日最高投与量は10mgまでとする。
7. 用法及び用量に関連する注意
- 7.1 中等度の肝機能障害患者(Child-Pugh分類B)への投与は1日1回2.5mgから開始し、慎重に投与する。投与量の上限は1日1回5mgまでとする。軽度の肝機能障害患者(Child-Pugh分類A)への投与は1日1回5mgから開始し、増量に際しては副作用発現に留意し、患者の状態を十分に観察しながら慎重に行うこと。,,
- 7.2 重度の腎機能障害患者(クレアチニンクリアランス30mL/min未満)への投与は1日1回2.5mgから開始し、慎重に投与する。投与量の上限は1日1回5mgまでとする。軽度及び中等度の腎機能障害患者(クレアチニンクリアランス30mL/min以上かつ80mL/min以下)への投与は1日1回5mgから開始し、増量に際しては副作用発現に留意し、患者の状態を十分に観察しながら慎重に行うこと。,,
- 7.3 高齢者では1日1回5mgから投与を開始し、増量に際しては副作用発現に留意し、患者の状態を十分に観察しながら慎重に行うこと。
8. 重要な基本的注意
9. 特定の背景を有する患者に関する注意
9.1 合併症・既往歴等のある患者
-
9.1.1 排尿困難のある患者(下部尿路閉塞疾患(前立腺肥大症等)又は排尿筋収縮障害等)
本剤投与前に残尿量測定を実施し、必要に応じて専門的な検査を考慮すること。また、投与中も十分に観察を行い、排尿困難の増悪を来していないかを定期的に確認すること。
- 9.1.2 下部尿路閉塞疾患(前立腺肥大症等)を合併している患者
- 9.1.3 QT延長症候群患者
-
9.1.4 潰瘍性大腸炎のある患者
中毒性巨大結腸があらわれるおそれがある。
-
9.1.5 甲状腺機能亢進症の患者
抗コリン作用により頻脈等の交感神経興奮症状が悪化するおそれがある。
-
9.1.6 認知症又は認知機能障害のある患者
抗コリン作用により、症状を悪化させるおそれがある。
-
9.1.7 パーキンソン症状又は脳血管障害のある患者
症状の悪化あるいは精神神経症状があらわれるおそれがある。
9.2 腎機能障害患者
9.3 肝機能障害患者
9.5 妊婦
妊婦又は妊娠している可能性のある女性には治療上の有益性が危険性を上回ると判断される場合にのみ投与すること。
9.6 授乳婦
治療上の有益性及び母乳栄養の有益性を考慮し、授乳の継続又は中止を検討すること。動物実験で乳汁中移行が報告されている。
9.7 小児等
小児等を対象とした有効性及び安全性を指標とした国内の臨床試験は実施していない。
10. 相互作用
10.2 併用注意(併用に注意すること)
| 薬剤名等 | 臨床症状・措置方法 | 機序・危険因子 |
|---|---|---|
|
口内乾燥、便秘、排尿困難等があらわれるおそれがある。 |
抗コリン作用が増強されるおそれがある。 |
|
|
口内乾燥、便秘、排尿困難等があらわれるおそれがあるので、減量するなど注意すること。 |
これらの薬剤はCYP3A4を強力に阻害し、併用により本剤の血中濃度が上昇する可能性がある。 |
|
|
本剤の作用が減弱する可能性がある。 |
これらの薬剤はCYP3A4を誘導し、併用により本剤の血中濃度が低下する可能性がある。 |
|
|
QT延長があらわれるおそれがあるので、過量投与に注意すること。 |
これらの薬剤によりQTが延長している患者に本剤が過量投与された場合、本剤のQT延長作用が相加的に作用する可能性がある。 |
11. 副作用
11.1 重大な副作用
-
11.1.1 ショック、アナフィラキシー(いずれも頻度不明)
蕁麻疹、呼吸困難、血圧低下等の異常が認められた場合には投与を中止し、適切な処置を行うこと。
-
11.1.2 肝機能障害
AST、ALT、γ-GTP、Al-P、総ビリルビンの上昇(各0.1~5%未満)等を伴う肝機能障害があらわれることがある。
- 11.1.3 尿閉(頻度不明)
- 11.1.4 QT延長、心室頻拍(Torsades de Pointesを含む)、房室ブロック、洞不全症候群、高度徐脈(いずれも頻度不明)
- 11.1.5 麻痺性イレウス(頻度不明)
- 11.1.6 幻覚・せん妄(頻度不明)
-
11.1.7 急性緑内障発作(頻度不明)
眼圧亢進、嘔気、頭痛を伴う眼痛、視力低下等があらわれることがあるので、観察を十分に行い、このような症状があらわれた場合には投与を中止し、直ちに適切な処置を行うこと。
11.2 その他の副作用
|
5%以上 |
0.1~5%未満 |
頻度不明 |
|
|---|---|---|---|
|
血液及びリンパ系障害 |
|
白血球数増多、白血球数減少、血小板数増多、血小板数減少 |
|
|
心臓障害 |
|
狭心症、上室性期外収縮、心室性期外収縮 |
徐脈、心房細動、頻脈、動悸 |
|
耳及び迷路障害 |
|
回転性めまい |
|
|
眼障害 |
|
霧視、調節障害、乾性角結膜炎、視力低下 |
|
|
胃腸障害 |
口内乾燥(28.3%)、便秘(14.4%) |
腹部不快感、腹部膨満、腹痛、下腹部痛、上腹部痛、下痢、消化不良、硬便、胃炎、萎縮性胃炎、舌炎、悪心、胃不快感、口内炎、舌変色 |
嘔吐、胃食道逆流性疾患、口の感覚鈍麻 |
|
全身障害及び投与局所様態 |
|
胸部不快感、胸痛、倦怠感、発熱 |
浮腫 |
|
感染症 |
|
膀胱炎、尿路感染、気管支炎、鼻咽頭炎、上気道感染、尿沈渣陽性 |
|
|
代謝及び栄養障害 |
|
CK上昇、尿酸上昇、総コレステロール上昇、K上昇、尿糖陽性 |
食欲減退 |
|
筋骨格系及び結合組織障害 |
|
関節痛、背部痛、側腹部痛 |
筋力低下 |
|
神経系障害 |
|
浮動性めまい、味覚異常、頭痛、傾眠 |
認知機能障害 |
|
精神障害 |
|
不眠症 |
|
|
腎及び尿路障害 |
|
排尿困難、膿尿、排尿躊躇、クレアチニン上昇、BUN上昇、尿蛋白陽性 |
|
|
呼吸器、胸郭及び縦隔障害 |
|
咳嗽、鼻乾燥、咽頭不快感 |
発声障害 |
|
皮膚及び皮下組織障害 |
|
皮膚乾燥、湿疹、そう痒症、発疹、蕁麻疹 |
血管浮腫、多形紅斑、剥脱性皮膚炎 |
|
血管障害 |
|
潮紅、高血圧 |
|
13. 過量投与
14. 適用上の注意
16. 薬物動態
16.1 血中濃度
-
16.1.1 単回投与
健康成人男性にソリフェナシンコハク酸塩錠「日医工」を絶食下単回経口投与したときのCmax及びAUCは、投与量にほぼ比例して上昇した。Tmax、t1/2及びCL/Fの平均値は各用量間でほぼ一定であった1) 。
表1 単回投与時のパラメータ 投与量
(mg)例数
Cmax
(ng/mL)Tmax
(h)AUCinf
(ng・h/mL)t1/2
(h)CL/F
(L/h)5
12
6.54±2.41
5.50±1.17
314.57±110.61
38.03±7.48
13.68±5.81
10
12
14.87±3.41
5.67±0.78
751.65±255.96
40.28±9.21
11.04±3.46
20 注1)
12
25.94±4.01
5.67±1.15
1,191.59±316.94
36.94±8.51
13.57±3.74
40 注1)
12
53.09±9.18
5.33±1.23
2,535.55±613.92
40.55±13.17
12.54±2.89
80 注1)
12
100.31±27.54
4.08±1.78
4,144.65±1,571.57
34.20±4.79
16.43±6.17
(平均値±標準偏差)
-
16.1.2 反復投与
健康高齢・非高齢男女にソリフェナシンコハク酸塩錠「日医工」の10mgを1日1回28日間反復経口投与したときの血漿中濃度は、投与後2~3週間で定常状態に達した。また、反復投与により血漿中濃度は単回投与時に比べ2~4倍に上昇した2) ,3) ,4) ,5) 。
表2 反復投与時のパラメータ 対象
例数
Cmax
(ng/mL)Tmax
(h)AUC24h
(ng・h/mL)t1/2
(h)CL/F
(L/h)非高齢男性
15
34.47±11.12
3.9±1.1
624.71±226.48
44.0±10.1
13.76±5.20
非高齢女性
14
37.57±18.31
5.2±1.4
732.82±375.83
39.2±9.1
12.83±5.71
高齢男性
16
52.89±23.47
4.6±1.6
1,091.27±493.88
71.1±28.3
8.60±4.68
高齢女性
16
53.82±10.27
5.6±1.8
1,095.61±213.19
61.3±13.1
7.18±1.69
(平均値±標準偏差)
-
16.1.3 過活動膀胱患者
第Ⅱ相試験において、母集団薬物動態解析により推定した過活動膀胱患者におけるCL/Fの母集団平均値は、男性が6.95L/h、女性が5.76L/hであった。母集団推定値から予想される10mg投与時の定常状態におけるAUC24hは、男性が1,085ng・h/mL、女性が1,309ng・h/mLであり、ソリフェナシンコハク酸塩錠「日医工」を10mg投与したときの血漿中濃度は健康高齢者とほぼ同じと考えられた6) ,7) 。
-
16.1.4 生物学的同等性試験
非高齢健康成人男性に2×2クロスオーバー法にてソリフェナシンコハク酸塩OD錠5mg「日医工」とソリフェナシンコハク酸塩錠5mg「日医工」をそれぞれ水とともに単回経口投与した場合、投与後4時間に最高血中濃度に達する。血中消失半減期は、約48時間であった。ヒトにソリフェナシンコハク酸塩OD錠「日医工」及びソリフェナシンコハク酸塩錠「日医工」を経口投与した場合、それぞれの剤形で血漿中未変化体濃度の推移はほぼ同じであり、生物学的に同等である8) ,9) 。
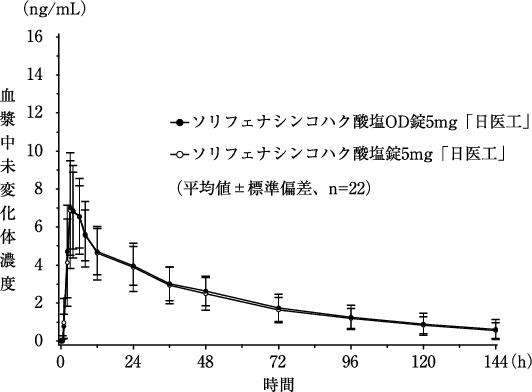
表3 薬物動態パラメータ 投与量
Cmax
(ng/mL)Tmax
(h)AUCinf
(ng・h/mL)t1/2
(h)CL/F
(L/h)ソリフェナシンコハク酸塩OD錠5mg「日医工」
7.35±2.19
3.8±1.2
380.43±170.68
48.3±18.2
12.68±10.22
ソリフェナシンコハク酸塩錠5mg「日医工」
7.46±2.73
4.1±1.2
358.23±133.57
47.7±11.6
14.88±18.50
(平均値±標準偏差)
16.2 吸収
16.4 代謝
本剤は肝臓において、主としてCYP3A4によって代謝され、一部CYP1A1、2C8、2C19、2D6及び3A5並びにグルクロン酸抱合酵素も代謝に関与していた。本剤を経口投与後、未変化体の他に薬理学的に活性のある代謝物4R-水酸化体と、活性がない3種の代謝物N-グルクロン酸抱合体、N-酸化体及び4R-水酸化-N-酸化体が血漿中及び尿中に認められた。血漿中では大部分が未変化体として存在し、4R-水酸化体の薬効への寄与は未変化体よりも低いと考えられた。未変化体及びこれら4種の代謝物は、本剤10mg投与時に予想される曝露レベルにおいて、CYP1A1/2、2C9、2C19、2D6及び3A4の代謝活性に影響を及ぼさなかった13) ,14) 。
16.5 排泄
14C標識体10mgを単回経口投与した後、投与量の69.2%の放射活性が尿中に、22.5%が糞中に回収された。尿中では投与量の15%未満が未変化体として排泄され、17.8%がN-酸化体、8.9%が4R-水酸化-N-酸化体、そして8.3%が4R-水酸化体としてそれぞれ排泄された13) (外国人データ)。
16.6 特定の背景を有する患者
-
16.6.1 腎機能障害患者
軽度(クレアチニンクリアランス50~80mL/min)から中等度(クレアチニンクリアランス30~49mL/min)の腎機能障害を持つ患者では、ソリフェナシンコハク酸塩錠「日医工」を10mg投与時のAUCは健康成人と比べてそれぞれ1.4倍及び1.3倍高かった。重度の腎機能障害(クレアチニンクリアランス30mL/min未満)を持つ患者では、健康成人と比べてAUCが2.1倍高かった15) (外国人データ)。,
-
16.6.2 肝機能障害患者
中等度(Child-Pugh分類B)の肝機能障害を持つ患者では、ソリフェナシンコハク酸塩錠「日医工」を10mg投与時のAUCは健康成人と比べて1.6倍高く、t1/2は2倍に延長した16) (外国人データ)。,,
-
16.6.3 高齢者
健康高齢者(65~75歳)にソリフェナシンコハク酸塩錠「日医工」の10mgを投与したときのCmax及びAUCは、非高齢者(21~34歳)と比べて1.5~1.8倍高く、t1/2は1.4~1.6倍に延長した2) ,3) 。
17. 臨床成績
17.1 有効性及び安全性に関する試験
-
17.1.1 国内第Ⅲ相試験
国内で実施された過活動膀胱患者を対象とした無作為化二重盲検並行群間比較試験における成績は以下のとおりであった。ソリフェナシンコハク酸塩錠「日医工」の5mgあるいは10mgを1日1回経口投与したときの結果は、主要評価項目である24時間あたりの平均排尿回数の変化量、副次的評価項目である24時間あたりの平均尿意切迫感回数の変化量、24時間あたりの平均切迫性尿失禁回数の変化量及び24時間あたりの平均尿失禁回数の変化量に関してソリフェナシンコハク酸塩錠「日医工」の5mg群、10mg群ともプラセボ群に比し有意な減少が認められた19) ,20) 。
副作用の発現率は、ソリフェナシンコハク酸塩錠「日医工」の5mg群で33.6%、10mg群で52.8%、プラセボ群で16.8%であり、ソリフェナシンコハク酸塩錠「日医工」投与群において発現率が2%以上であった副作用は、口内乾燥、便秘、霧視、排尿困難であった21) 。表4 最終評価時の24時間あたりの平均排尿回数変化量 投与群
症例数
平均値
標準偏差
両側95%信頼区間
下限
上限
プラセボ
395
-0.94
2.286
-1.164
-0.712
ソリフェナシンコハク酸塩錠「日医工」(5mg)
383
-1.93
1.974
-2.133
-1.736
ソリフェナシンコハク酸塩錠「日医工」(10mg)
371
-2.19
2.090
-2.406
-1.979
表5 最終評価時の24時間あたりの平均尿意切迫感回数変化量 投与群
症例数
平均値
標準偏差
両側95%信頼区間
下限
上限
プラセボ
395
-1.28
2.899
-1.563
-0.989
ソリフェナシンコハク酸塩錠「日医工」(5mg)
383
-2.41
2.877
-2.697
-2.119
ソリフェナシンコハク酸塩錠「日医工」(10mg)
371
-2.78
2.819
-3.072
-2.497
表6 最終評価時の24時間あたりの平均切迫性尿失禁回数変化量 投与群
症例数
平均値
標準偏差
両側95%信頼区間
下限
上限
プラセボ
260
-0.69
2.002
-0.932
-0.443
ソリフェナシンコハク酸塩錠「日医工」(5mg)
235
-1.45
1.886
-1.688
-1.204
ソリフェナシンコハク酸塩錠「日医工」(10mg)
255
-1.52
1.771
-1.735
-1.298
表7 最終評価時の24時間あたりの平均尿失禁回数変化量 投与群
症例数
平均値
標準偏差
両側95%信頼区間
下限
上限
プラセボ
283
-0.72
1.951
-0.950
-0.493
ソリフェナシンコハク酸塩錠「日医工」(5mg)
274
-1.59
2.117
-1.843
-1.339
ソリフェナシンコハク酸塩錠「日医工」(10mg)
270
-1.60
1.810
-1.817
-1.383
17.3 その他
-
17.3.1 QT間隔に対する影響
ソリフェナシンコハク酸塩錠「日医工」反復投与時のQT間隔に及ぼす影響を検討することを目的として、健康成人女性86例を対象に二重盲検比較対照試験を実施した。ソリフェナシンコハク酸塩錠「日医工」を10mg投与時の定常状態において、QT間隔の変化はプラセボと同程度であった。一方、ソリフェナシンコハク酸塩錠「日医工」を30mg投与時の定常状態、及びモキシフロキサシン400mgの単回投与時においてQT間隔の増加が認められた22) (外国人データ)。,,,
表8 定常状態におけるQT間隔のベースラインからの変化量(プラセボとの差) 薬剤
QTc注1)
(msec)90%信頼区間
下限
上限
コハク酸ソリフェナシン10mg/日
0
-5
5
コハク酸ソリフェナシン30mg/日 注2)
6
1
11
モキシフロキサシン400mg/日
10
6
13
注1)被験者毎に補正したQTcの推定値。被験者毎にQT及びRR間隔の実測値を直線回帰式に当てはめ、QTcを求めた。
18. 薬効薬理
18.1 作用機序
膀胱平滑筋において、ムスカリンM3受容体拮抗作用を示すことにより、膀胱の過緊張状態を抑制し、過活動膀胱における尿意切迫感、頻尿及び切迫性尿失禁を改善する23) 。
18.2 ムスカリン受容体に対する親和性
ヒトムスカリン受容体を用いた結合実験において、ムスカリンM3受容体に対する親和性はムスカリンM1、M2、M4及びM5受容体に対する親和性より高かった23) (in vitro)。
18.3 ムスカリン受容体拮抗作用
- 18.3.1 ラット及びモルモット膀胱平滑筋標本を用いた摘出実験において、カルバコール刺激による収縮に対して濃度依存的かつ競合的な拮抗作用を示した24) 。また、ラット及びカニクイザルの膀胱平滑筋細胞及び顎下腺細胞において、カルバコール刺激による細胞内カルシウム濃度上昇に対して濃度依存的な抑制作用を示したが、顎下腺よりも膀胱平滑筋に対する抑制作用がそれぞれ3.6倍及び2.1倍強かった25) ,26) (in vitro)。
- 18.3.2 麻酔ラットにおいて、カルバコール刺激による膀胱内圧上昇及び唾液分泌に対して用量依存的な抑制作用を示した。膀胱内圧上昇及び唾液分泌をそれぞれ30%及び50%抑制する用量で比較すると、唾液分泌よりも膀胱内圧上昇に対する抑制作用がそれぞれ6.5倍及び3.7倍強かった25) (in vivo)。
19. 有効成分に関する理化学的知見
一般的名称
コハク酸ソリフェナシン(Solifenacin Succinate)
化学名
(3R)-1-Azabicyclo[2.2.2]oct-3-yl(1S)-1-phenyl-3,4-dihydroisoquinoline-2(1H)-carboxylate monosuccinate
分子式
C23H26N2O2・C4H6O4
分子量
480.55
性状
コハク酸ソリフェナシンは白色の結晶又は結晶性の粉末である。水、ジメチルスルホキシド又はメタノールに溶けやすく、エタノール(99.5)にやや溶けにくい。水酸化ナトリウム試液に溶ける。
化学構造式
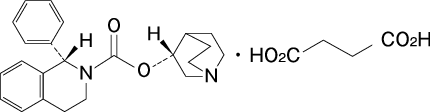
融点
144~149℃
20. 取扱い上の注意
本品はアルミ袋により品質保持をはかっているので、アルミ袋開封後は湿気を避けて保存すること。
22. 包装
23. 主要文献
1) 田中孝典 他:薬理と治療. 2006;34(Suppl.1):S5-S13
2) 鈴木真奈絵 他:薬理と治療. 2006;34(Suppl.1):S29-S40
3) 社内資料:国内高齢者・性差試験(ベシケア錠2006年4月20日承認 CTD 2.7.2.2)
4) 田中孝典 他:薬理と治療. 2006;34(Suppl.1):S15-S27
5) 社内資料:薬物動態試験(ベシケア錠2006年4月20日承認 CTD 5.3.3.3)
6) 山口脩 他:薬理と治療. 2006;34(Suppl.1):S47-S68
7) 社内資料:過活動膀胱患者における薬物動態(ベシケア錠2006年4月20日承認 CTD 2.5.3.7)
10) Kuipers M.E.et al.:Drugs in R&D.2004;5(2):73-81
11) 田中孝典 他:薬理と治療. 2006;34(Suppl.1):S41-S45
12) 社内資料:分布(ベシケア錠2006年4月20日承認 CTD 2.6.4.4)
13) 社内資料:海外健康成人・代謝(ベシケア錠2006年4月20日承認 CTD 2.7.6.6)
14) 社内資料:代謝(ベシケア錠2006年4月20日承認 CTD 2.6.4.5、2.7.2.2、2.7.2.3、5.3.2.2)
15) Smulders R.A.et al.:J.Pharmacol.Sci.2007;103(1):67-74
16) Kuipers M.et al.:J.Pharmacol.Sci.2006;102(4):405-412
17) Swart P.J.et al.:Basic Clin.Pharmacol.Toxicol.2006;99(1):33-36
18) 社内資料:海外健康成人・相互作用(ベシケア錠2006年4月20日承認 CTD 2.7.6.12)
19) Yamaguchi O.et al.:BJU Int.2007;100(3):579-587
20) 社内資料:国内二重盲検群間比較試験(ベシケア錠2006年4月20日承認 CTD 2.7.3.3)
21) 社内資料:国内二重盲検群間比較試験(ベシケア錠2006年4月20日承認 CTD 2.7.4.7)
22) 社内資料:海外健康成人・二重盲検比較対照試験(ベシケア錠2006年4月20日承認 CTD 2.7.6.17)
23) Ohtake A.et al.:Biol.Pharm.Bull.2007;30(1):54-58
24) 社内資料:ムスカリンM3受容体拮抗、排尿機能(ベシケア錠2006年4月20日承認 CTD 2.6.2.1)
25) Ohtake A.et al.:Eur.J.Pharmacol.2004;492(2-3):243-250
24. 文献請求先及び問い合わせ先
日医工株式会社 お客様サポートセンター
〒930-8583 富山市総曲輪1丁目6番21
TEL(0120)517-215
FAX(076)442-8948
26. 製造販売業者等
26.1 製造販売元
日医工株式会社
富山市総曲輪1丁目6番21