バルデナフィル錠5mg「FCI」/バルデナフィル錠10mg「FCI」/バルデナフィル錠20mg「FCI」
作成又は改訂年月
| * | 2023年 8月改訂 ( 第1版 ) |
日本標準商品分類番号
薬効分類名
承認等
バルデナフィル錠5mg「FCI」
販売名コード
YJコード
販売名英語表記
販売名ひらがな
承認番号等
承認番号
販売開始年月
貯法・有効期間
貯法
有効期間
規制区分
処方箋医薬品 注)
注) 注意―医師等の処方箋により使用することバルデナフィル錠10mg「FCI」
販売名コード
YJコード
販売名英語表記
販売名ひらがな
承認番号等
承認番号
販売開始年月
貯法・有効期間
貯法
有効期間
規制区分
処方箋医薬品 注)
注) 注意―医師等の処方箋により使用することバルデナフィル錠20mg「FCI」
販売名コード
YJコード
販売名英語表記
販売名ひらがな
承認番号等
承認番号
販売開始年月
貯法・有効期間
貯法
有効期間
規制区分
処方箋医薬品 注)
注) 注意―医師等の処方箋により使用すること一般的名称
2. 禁忌(次の患者には投与しないこと)
- 2.1 本剤の成分に対し過敏症の既往歴のある患者
- 2.2 硝酸剤あるいは一酸化窒素(NO)供与剤(ニトログリセリン、亜硝酸アミル、硝酸イソソルビド、ニコランジル等)を投与中の患者,
- 2.3 心血管系障害を有するなど性行為が不適当と考えられる患者,
- 2.4 先天性のQT延長患者(QT延長症候群)、クラスIA(キニジン、プロカインアミド、ジソピラミド(経口剤)、シベンゾリン、ピルメノール)又はクラスⅢ(アミオダロン(経口剤)、ソタロール)の抗不整脈薬を投与中の患者,
- 2.5 脳梗塞・脳出血や心筋梗塞の既往歴が最近6ヵ月以内にある患者,
- 2.6 重度の肝障害のある患者
- 2.7 血液透析が必要な腎障害のある患者
- 2.8 低血圧(安静時収縮期血圧<90mmHg)又は治療による管理がなされていない高血圧(安静時収縮期血圧>170mmHg又は安静時拡張期血圧>100mmHg)患者,
- 2.9 不安定狭心症のある患者,
- 2.10 *リオシグアト、CYP3A4を阻害する薬剤(リトナビル、アタザナビル、ホスアンプレナビル、ロピナビル・リトナビル、ニルマトレルビル・リトナビル、ダルナビルを含有する製剤、ケトコナゾール(外用剤を除く)、イトラコナゾール、エンシトレルビル、コビシスタットを含有する製剤)を投与中の患者
- 2.11 網膜色素変性症患者[網膜色素変性症の患者にはホスホジエステラーゼ(PDE)の遺伝的障害を持つ症例が少数認められる。]
5. 効能又は効果に関連する注意
6. 用法及び用量
7. 用法及び用量に関連する注意
8. 重要な基本的注意
- 8.1 性行為は心臓へのリスクを伴うため、勃起不全の治療を開始する前に心血管系の状態に注意を払うこと。本剤は血管拡張作用を有するため一過性の軽度な血圧低下があらわれる場合がある。,,,,
- 8.2 臨床薬理試験において本剤投与によるQTc延長がみられていることから、心血管系障害又は肝障害のある患者に対しては、本剤投与中に必要に応じて心電図検査を実施することが望ましい。,
- 8.3 4時間以上の勃起の延長又は持続勃起(6時間以上持続する痛みを伴う勃起)が外国臨床試験で少数例報告されている。持続勃起に対する処置を速やかに行わないと陰茎組織の損傷又は勃起機能を永続的に損なうことがあるので、勃起が4時間以上持続する症状がみられた場合には直ちに医師の診断を受けるよう指導すること。
- 8.4 臨床試験において、めまいや視覚障害が認められているので、高所作業、自動車の運転等危険を伴う機械を操作する際には注意させること。
- 8.5 本剤投与後に急激な視力低下又は急激な視力喪失があらわれた場合には、本剤の服用を中止し、速やかに眼科専門医の診察を受けるよう、患者に指導すること。
9. 特定の背景を有する患者に関する注意
9.1 合併症・既往歴等のある患者
-
9.1.1 陰茎の構造上欠陥(屈曲、陰茎の線維化、Peyronie病等)のある患者
性行為が困難であり痛みを伴う可能性がある。
- 9.1.2 持続勃起症の素因となり得る疾患(鎌状赤血球性貧血、多発性骨髄腫、白血病等)のある患者
-
9.1.3 PDE5阻害薬又は他の勃起不全治療薬を投与中の患者
これらの薬剤との併用使用の経験がない。
-
9.1.4 出血性疾患又は消化性潰瘍のある患者
ニトロプルシドナトリウム(NO供与剤)の血小板凝集抑制作用を増強することが認められている。出血性疾患又は消化性潰瘍のある患者に対する安全性は確立していない。
-
9.1.5 大動脈弁狭窄症、特発性肥大性大動脈弁下狭窄症等、左室流出路の閉塞のある患者
本剤の血管拡張作用による影響を受ける場合がある。心血管系の状態によって性行為が望ましくない患者には勃起不全治療薬の使用は行うべきではない。
9.3 肝機能障害患者
10. 相互作用
10.1 併用禁忌(併用しないこと)
| 薬剤名等 | 臨床症状・措置方法 | 機序・危険因子 |
|---|---|---|
|
併用により降圧作用が増強し、過度に血圧を下降させることがある。 |
NOはcGMPの産生を刺激し、一方、本剤はcGMPの分解を抑制することから、両剤の併用によりcGMPの増大を介するNOの降圧作用が増強する。 |
|
|
症候性低血圧を起こすことがある。 |
細胞内cGMP濃度が増加し、全身血圧に相加的な影響を及ぼすおそれがある。 |
|
|
本剤のAUC0-24が49倍に増加し、Cmaxが13倍に上昇し、半減期が10倍に延長するとの報告がある1) 。 |
CYP3A4阻害によりクリアランスが減少する。 |
|
|
本剤の血漿中濃度が上昇し、半減期が延長するおそれがある。 |
CYP3A4阻害によりクリアランスが減少する。 |
|
|
本剤のAUCが10倍に増加し、Cmaxが4倍に上昇するとの報告がある2) 。 |
CYP3A4阻害によりクリアランスが減少する。 |
|
|
*本剤の血漿中濃度が上昇するおそれがある。 |
*CYP3A4阻害によりクリアランスが減少する。 |
|
|
*本剤の血漿中濃度が上昇するおそれがある。 |
*コビシスタットのCYP3A4阻害によりクリアランスが減少する。 |
|
|
本剤の心臓伝導系への影響を検討する臨床薬理試験において本剤投与によるQTc延長がみられている3) 。 |
これらの薬剤はいずれもQTc延長作用がみられている。本剤を併用した場合、相加的なQTc延長がみられるおそれがある。 |
10.2 併用注意(併用に注意すること)
| 薬剤名等 | 臨床症状・措置方法 | 機序・危険因子 |
|---|---|---|
|
エリスロマイシンで、本剤のAUCが4倍に増加し、Cmaxが3倍に上昇するとの報告がある4) 。 |
CYP3A4阻害によりクリアランスが減少する。 |
|
|
本剤の血漿中濃度が上昇するおそれがある。 |
CYP3A4阻害によりクリアランスが減少する。 |
|
|
本剤の血漿中濃度が低下するおそれがある。 |
CYP3A4誘導によりクリアランスが増加する。 |
|
|
カルペリチド |
併用により、降圧作用が増強するおそれがある。 |
本剤は血管拡張作用による降圧作用を有するため、併用により降圧作用が増強するおそれがある。 |
|
本剤は血管拡張作用による降圧作用を有するため、併用により降圧作用が増強する。 |
11. 副作用
11.2 その他の副作用
|
1%以上 |
0.1~1%未満 |
0.1%未満 |
頻度不明 |
|
|---|---|---|---|---|
|
循環器 |
ほてり(10.6%)、心悸亢進 |
頻脈、高血圧 |
失神、低血圧、顔面浮腫、心筋虚血、心筋梗塞 注1) |
起立性低血圧、狭心症 |
|
精神神経系 |
頭痛(11.7%)、めまい |
不眠症、異常感覚、傾眠、眩暈、感覚鈍麻 |
不安、緊張亢進、一過性全健忘 | |
|
肝臓 |
肝機能検査異常、γ-GTP上昇 | |||
|
呼吸器 |
鼻閉 |
副鼻腔うっ血、呼吸困難、鼻出血 | ||
|
筋・骨格系 |
背部痛、筋肉痛 |
関節痛、頸部痛 | ||
|
皮膚 |
紅斑、発汗、そう痒、光線過敏性反応、発疹 | |||
|
消化器 |
消化不良、嘔気 |
腹痛、口内乾燥、下痢、胃炎、嘔吐、胃食道逆流 |
嚥下障害、食道炎 | |
|
感覚器 |
視覚異常、結膜炎、霧視、羞明、彩視症、眼痛、耳鳴、流涙 |
緑内障 |
||
|
その他 |
CK上昇、灼熱感、無力症、胸痛、異常感、勃起増強(勃起時疼痛等) |
インフルエンザ症候群、射精障害、アナフィラキシー反応、持続勃起 |
14. 適用上の注意
15. その他の注意
15.1 臨床使用に基づく情報
-
15.1.1 薬剤との因果関係は明らかではないが、外国において本剤を含むPDE5阻害薬投与中に、まれに、視力低下や視力喪失の原因となりうる非動脈炎性前部虚血性視神経症(NAION)の発現が報告されている。これらの患者の多くは、NAIONの危険因子[年齢(50歳以上)、糖尿病、高血圧、冠動脈障害、高脂血症、喫煙等]を有していた。
外国において、NAIONを発現した45歳以上の男性を対象として実施された自己対照研究では、PDE5阻害薬の投与から消失半減期(t1/2)の5倍の期間内(バルデナフィルの場合約1日以内に相当)は、NAION発現リスクが約2倍になることが報告されている9) 。 - 15.1.2 薬剤との因果関係は明らかではないが、外国において本剤を含むPDE5阻害薬投与後に、まれに、痙攣発作の発現が報告されている10) ,11) 。
- 15.1.3 薬剤との因果関係は明らかではないが、外国において本剤を含むPDE5阻害薬投与後に、まれに、急激な聴力低下又は突発性難聴が報告されている。これらの患者では、耳鳴りやめまいを伴うことがある。
16. 薬物動態
16.1 血中濃度
-
16.1.1 単回投与
日本人健康成人男子18例に、バルデナフィル10mg、20mg及び40mgを空腹時単回経口投与した場合 注2) 、血漿中未変化体濃度は投与後0.75時間にピークに達し、以後約3.2~5.3時間の半減期で速やかに消失した。未変化体のAUC及びCmaxは、用量比にほぼ応じて増加した12) 。
投与量
AUC
(μg・h/L)Cmax
(μg/L)tmax
(h)t1/2
(h)10mg
20.94(1.72)
10.05(1.86)
0.75(0.50~1.00)
3.19(1.08)
20mg
44.14(1.39)
18.35(1.29)
0.75(0.50~1.00)
3.98(1.46)
40mg
137.73(1.72)
51.71(1.86)
0.75(0.50~1.00)
5.33(1.20)
幾何平均値(幾何標準偏差)、n=6 ※中央値(範囲)
-
16.1.2 反復投与
健康成人男子43例に、バルデナフィルを1日1回14日間(40mg)、1日1回(20、40mg)又は隔日1回(40mg)31日間反復経口投与した場合 注2) 、血漿中未変化体濃度推移は、いずれの投与量、投与方法及び投与期間においても初回投与後とほぼ同様であった。また、未変化体の薬物動態パラメータにも大きな変動はみられず、反復投与による蓄積性は認められなかった13) ,14) (外国人データ)。
-
16.1.3 生物学的同等性試験〈バルデナフィル錠20mg「FCI」〉
バルデナフィル錠20mg「FCI」又はレビトラ錠20mgをクロスオーバー法により、それぞれ1錠(バルデナフィルとして20mg)を健康成人男子に絶食単回経口投与(n=57)して血漿中未変化体濃度を測定し、得られた薬物動態パラメータ(AUC、Cmax)について90%信頼区間法にて統計解析を行った結果、log(0.80)~log(1.25)の範囲内であり、両剤の生物学的同等性が確認された15) 。
判定パラメータ
参考パラメータ
AUC
(ng・hr/mL)Cmax
(ng/mL)Tmax
(hr)T1/2
(hr)バルデナフィル錠20mg「FCI」
89.870
±46.71331.124
±18.3620.83
±0.463.66
±1.00レビトラ錠20mg
88.645
±43.65031.258
±18.7510.94
±0.603.67
±0.97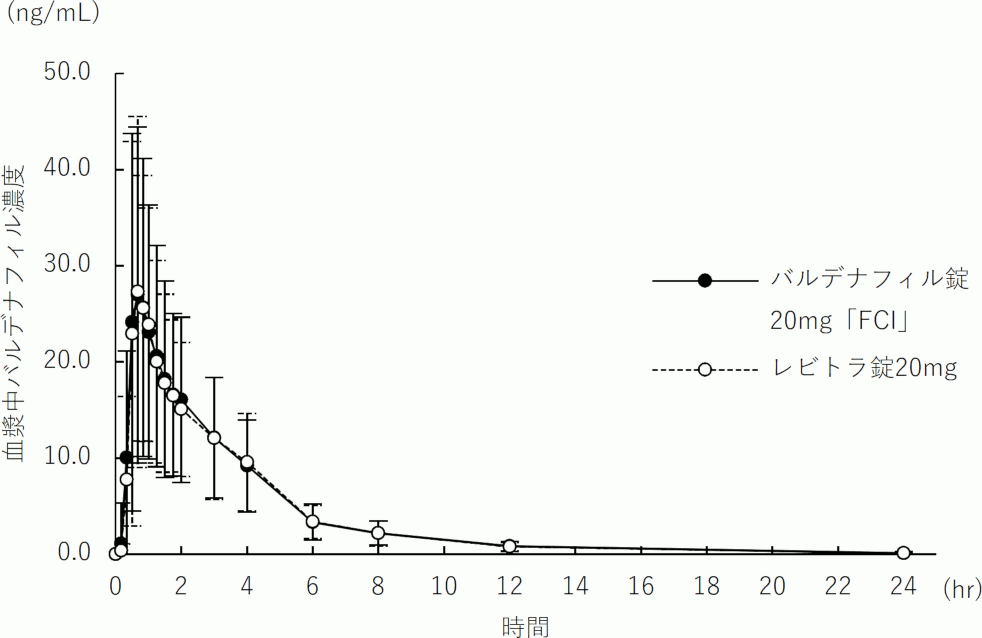 (Mean±S.D., n=57)
(Mean±S.D., n=57)
血漿中濃度並びにAUC、Cmax等のパラメータは、被験者の選択、体液の採取回数・時間等の試験条件によって異なる可能性がある。
16.2 吸収
16.3 分布
-
16.3.1 血漿タンパク結合率
未変化体及び血漿中主代謝物であるN-脱エチル体(M1)の血漿タンパク結合率は、血漿中濃度にかかわらず、いずれも約95%であり、その結合は可逆的であった18) (in vitro)。
16.4 代謝
血漿中主代謝物はM1であり、未変化体とほぼ等量存在したが、その多くはN-グルクロン酸抱合体であった。尿中及び糞中ではM1が主代謝物として認められたが、糞中ではN、N’-脱エチレン体がM1についで多く存在した。これら排泄物中への未変化体の排泄率はそれぞれ投与量の1%未満とわずかであった19) (外国人データ)。
16.6 特定の背景を有する患者
-
16.6.1 腎障害患者
健康成人男子8例及び腎障害患者24例に、バルデナフィル20mgを空腹時単回経口投与した場合、中等度の腎障害患者(CLcr=30~50mL/min)の未変化体AUC及びCmax、重度の腎障害患者(CLcr≦30mL/min)の未変化体AUCは、健康成人男子に比べ約1.2~1.4倍とやや高い値を示したが、CLcrとAUCあるいはCmaxとの間に有意な相関は認められなかった20) (外国人データ)。
-
16.6.2 肝障害患者
健康成人男子6例及び肝障害患者12例に、バルデナフィル10mgを空腹時単回経口投与した場合、中等度の肝障害患者(Child-Pugh分類B)の未変化体AUC及びCmaxは健康成人男子と比べ、約2.3~2.6倍に増加した21) (外国人データ)。,
-
16.6.3 高齢者
健康な非高齢男子(18~45歳)8例及び高齢男子(66~78歳)9例に、バルデナフィル40mgを空腹時単回経口投与した場合 注2) 、高齢男子では未変化体のAUC及びCmaxが非高齢男子に比べて約1.3~1.5倍とやや高かった22) (外国人データ)。
16.7 薬物相互作用
-
16.7.1 リトナビル
健康成人男子18例に対し、リトナビル600mg1日2回反復投与時に、バルデナフィル5mgを空腹時単回投与した場合、バルデナフィルのAUC0-24及びCmaxが単独投与時と比較して、それぞれ49倍及び13倍に増加し、t1/2が10倍に延長した1) (外国人データ)。
-
16.7.2 ケトコナゾール
健康成人男子12例に対し、ケトコナゾール200mgを経口にて1日1回反復投与時(経口剤は国内未発売)にバルデナフィル5mgを空腹時単回投与した場合、バルデナフィルのAUC及びCmaxが単独投与時と比較して、それぞれ10倍及び4倍に増加した。t1/2の延長は認められなかった2) (外国人データ)。
-
16.7.3 エリスロマイシン
健康成人男子12例に対し、エリスロマイシン500mg1日3回反復投与時にバルデナフィル5mgを空腹時単回投与した場合、バルデナフィルのAUC及びCmaxが単独投与時と比較して、それぞれ4倍及び3倍に増加した。t1/2の延長は認められなかった4) (外国人データ)。
-
16.7.4 テラゾシン
中高年健康成人男子30例に対し、テラゾシン10mg1日1回 注3) 反復投与時の定常状態において、バルデナフィル10mg、20mg及びプラセボをテラゾシンと同時並びに投与6時間後に単回投与した。バルデナフィルをテラゾシンと同時に投与した場合、プラセボを投与した時に比べて、立位の収縮期血圧で最大14~23mmHg、拡張期血圧で最大9mmHg低下した。バルデナフィルをテラゾシン投与6時間後に投与した場合には、立位血圧がそれぞれ最大7~11mmHg及び4~7mmHg低下した5) 。
テラゾシンによる治療で患者の状態が安定している前立腺肥大患者21例に対し、バルデナフィル5mg及びプラセボをテラゾシンと同時並びに投与6時間後に単回投与した。バルデナフィルをテラゾシンと同時に投与した場合、プラセボを投与した時に比べて、臥位の収縮期血圧で最大4mmHg、拡張期血圧で最大2mmHg低下し、立位の収縮期血圧で最大3mmHg、拡張期血圧で最大2mmHg低下した。バルデナフィルをテラゾシン投与6時間後に投与した場合には、臥位血圧がそれぞれ最大4mmHg及び5mmHg低下し、立位の収縮期血圧で最大4mmHg、拡張期血圧で最大3mmHg低下した7) (外国人データ)。 -
16.7.5 タムスロシン
中高年健康成人男子30例に対し、タムスロシン0.4mg1日1回 注4) 反復投与時の定常状態において、バルデナフィル10mg、20mg及びプラセボをタムスロシン投与4時間後並びに投与10時間後に単回投与した。バルデナフィルをタムスロシン投与4時間後に投与した場合、プラセボを投与した時に比べて、立位の収縮期血圧で最大8mmHg、拡張期血圧で最大7mmHg低下した。バルデナフィルをタムスロシン投与10時間後に投与した場合には、立位血圧がそれぞれ最大4~8mmHg及び3~4mmHg低下した6) 。
タムスロシンによる治療で患者の状態が安定している前立腺肥大患者21例に対し、バルデナフィル5mg及びプラセボをタムスロシンと同時並びに投与6時間後に単回投与した。バルデナフィルをタムスロシンと同時に投与した場合、プラセボを投与した時に比べて、臥位の収縮期血圧で最大4mmHg、拡張期血圧で最大1mmHg低下し、立位の収縮期血圧で最大6mmHg、拡張期血圧で最大2mmHg低下した。バルデナフィルをタムスロシン投与6時間後に投与した場合には、臥位血圧がそれぞれ最大5mmHg及び3mmHg低下し、立位の収縮期血圧で最大4mmHg、拡張期血圧で最大2mmHg低下した7) 。
タムスロシンによる治療で患者の状態が安定している前立腺肥大患者23例に対し、バルデナフィル10mg、20mg及びプラセボをタムスロシンと同時に単回投与した。バルデナフィルをタムスロシンと同時に投与した場合、プラセボを投与した時に比べて、臥位の収縮期血圧で最大4~5mmHg、拡張期血圧で最大2~3mmHg低下し、立位の収縮期血圧で最大4mmHg、拡張期血圧で最大1~3mmHg低下した8) (外国人データ)。 -
16.7.6 その他の薬剤
制酸剤(水酸化アルミニウムゲル・水酸化マグネシウム配合剤)、シメチジン、ラニチジン、ジゴキシン、ワルファリン、グリベンクラミド、ニフェジピン、アスピリン、アルコールとの相互作用について臨床試験により検討しているが、バルデナフィル併用による薬物動態学的相互作用は認められなかった。また、バルデナフィル投与によりニフェジピン又はアルコールの降圧作用に対する明らかな増強は認められず、さらにワルファリン及びアスピリン使用時の凝固能にも影響を及ぼさなかった23) ,24) ,25) ,26) ,27) ,28) ,29) ,30) (外国人データ)。
16.8 その他
-
16.8.1 バルデナフィル錠5mg「FCI」、バルデナフィル錠10mg「FCI]
バルデナフィル錠5mg「FCI」およびバルデナフィル錠10mg「FCI」は、「含量が異なる経⼝固形製剤の⽣物学的同等性試験ガイドライン」(平成24年2⽉29⽇薬⾷審査発0229第10号)に基づき、バルデナフィル錠20mg「FCI」を標準製剤としたとき、溶出挙動が同等と判断され、⽣物学的に同等とみなされた31) 。
17. 臨床成績
17.1 有効性及び安全性に関する試験
-
17.1.1 国内用量反応試験(ブリッジング試験)
国内用量反応試験(ブリッジング試験)における臨床効果はIIEF(International Index of Erectile Function:国際勃起機能スコア)質問票(15質問)の内、挿入の頻度に関する質問「ここ4週間、性交を試みた時、何回挿入することができましたか?」及び勃起の維持に関する質問「ここ4週間、性交中、挿入後何回勃起を維持することができましたか?」を以下のスコアで評価した。
性交の試み一度もなし …………………………………0
毎回又はほぼ毎回(10回中9回以上) …………………5
おおかた毎回(半分よりかなり上回る回数:10回中7回程度) …………………………………………………………………4
時々(10回中5回) ………………………………………3
たまに(半分よりかなり下回る回数:10回中3回程度)…………………………………………………………………2
全くなし又はほとんどなし(10回中1回以下) ………1
バルデナフィル5mg群及び10mg群においてプラセボに比し有意な改善がみられた。なお、本試験では糖尿病患者、脊髄損傷による勃起不全患者、根治的前立腺全摘除術の既往のある患者は対象から除外されている。プラセボ
バルデナフィル
5mg
10mg
挿入の頻度
N=71
N=67
N=75
投与前
投与後2.6
3.2±0.1
2.9
4.1±0.1
p<0.00012.8
4.5±0.1
p<0.0001勃起の維持
N=71
N=67
N=75
投与前
投与後
1.5
2.3±0.21.6
3.5±0.2
p<0.00011.5
4.2±0.2
p<0.0001投与前の値は算術平均値(Mean)、投与後の値は調整済平均値(LS mean)±SE。
検定は共分散分析を用いたプラセボとの比較。
副作用は、プラセボ群では21.1%(15/71例)、5mg群では35.3%(24/68例)、10mg群では45.3%(34/75例)、20mg群では54.5%(36/66例)に認められた32) 。 -
17.1.2 糖尿病を有する勃起不全患者に対する国内臨床比較試験
IIEF質問票の内、勃起機能ドメインスコア(質問1~質問5及び質問15の総和)により評価した結果、バルデナフィル10mg群及び20mg群ともにプラセボに比し有意な改善がみられた。また、20mg投与群と10mg投与群との間に統計学的に有意な差(p<0.05)が認められた。
プラセボ
バルデナフィル
10mg
20mg
IIEF勃起機能
ドメインスコアN=106
N=337
N=335
投与前
投与後13.7
16.3±0.713.6
21.8±0.4
p<0.000113.9
22.9±0.4
p<0.0001投与前の値は算術平均値(Mean)、投与後の値は調整済平均値(LS mean)±SE。
検定は共分散分析を用いたプラセボとの比較。
副作用は、プラセボ群では6.6%(7/106例)、10mg群では22.0%(74/337例)、20mg群では24.2%(81/335例)に認められた33) ,34) 。バルデナフィル10mgで治療を開始し、投与4週後の時点で十分な治療効果が得られず、忍容性が良好であった症例に対して20mgへ増量した結果、勃起機能の更なる改善が認められた。
投与パターン*
10mg→10mg
10mg→20mg
IIEF勃起機能
ドメインスコアN=10
N=22
投与前
投与4週後12.2±7.3
26.9±4.310.3±5.7
17.5±7.5投与8週後
投与12週後27.3±2.3
25.0±8.522.3±8.1
22.2±8.1算術平均値(Mean)±SD
※:バルデナフィル10mgを開始用量として、投与4週後に増量の可否を行った。
副作用は、10mgを継続した症例では40.0%(4/10例)、20mgへ増量した症例では13.6%(3/22例)に認められた。
国内では、糖尿病及び脊髄損傷を有する患者以外の器質性又は混合型勃起不全患者に対して、バルデナフィル20mgへの増量によるリスク・ベネフィットは検討されていない35) ,36) 。 -
17.1.3 北アメリカ第Ⅲ相試験
外国で実施された第Ⅲ相試験においては、IIEF勃起機能ドメインスコア並びに患者日記/「挿入の成功」、患者日記/「勃起の持続」により評価した結果、バルデナフィル5mg群及び10mg群においてプラセボに比し有意な改善がみられた。
プラセボ
バルデナフィル
5mg
10mg
IIEF勃起機能
ドメインスコアN=170
N=188
N=195
投与前
投与後13.6
15.0±0.712.5
18.4±0.6
p<0.000113.4
20.6±0.6
p<0.0001患者日記/
「挿入の成功」(%)N=171
N=189
N=194
投与前
投与後46.0
51.7±2.542.8
65.5±2.4
p<0.000145.4
75.5±2.4
p<0.0001患者日記/
「勃起の維持」(%)N=171
N=188
N=194
投与前
投与後14.9
32.2±2.714.0
50.6±2.6
p<0.000114.6
64.5±2.6
p<0.0001投与前の値は調整済平均値(LS mean)、投与後の値は調整済平均値(LS mean)±SE。
検定は共分散分析を用いたプラセボとの比較。
副作用は、プラセボ群では7.1%(13/182例)、5mg群では19.2%(37/193例)、10mg群では33.2%(66/199例)、20mg群では42.0%(79/188例)に認められた37) ,38) 。 -
17.1.4 ヨーロッパ第Ⅲ相試験
外国で実施された第Ⅲ相試験(投与例数:プラセボ群160例、バルデナフィル5mg群156例、10mg157例)においては、IIEF勃起機能ドメインスコア並びに患者日記/「挿入の成功」、患者日記/「勃起の持続」により評価した結果、バルデナフィル5mg群及び10mg群においてプラセボに比し有意な改善がみられた。
プラセボ
バルデナフィル
5mg
10mg
IIEF勃起機能
ドメインスコア
投与前
投与後13.0
13.2±0.613.2
19.8±0.6
P<0.000113.0
20.9±0.6
p<0.0001患者日記/
「挿入の成功」
(%)投与前
投与後41.7
45.3±2.647.8
71.7±2.6
p<0.000143.9
76.4±2.6
p<0.0001患者日記/
「勃起の維持」
(%)投与前
投与後15.9
24.9±2.914.6
54.9±2.9
p<0.000115.9
61.6±2.9
p<0.0001投与前の値は調整済平均値(LS mean)、投与後の値は調整済平均値(LS mean)±SE。
検定は共分散分析を用いたプラセボとの比較。
副作用は、プラセボ群では10.0%(16/160例)、5mg群では19.1%(30/157例)、10mg群では27.7%(44/159例)、20mg群では40.5%(66/163例)に認められた39) 。
17.3 その他
-
17.3.1 QT間隔に対する影響
健康成人男子59例に対し、バルデナフィル10mg、80mg 注5) 、シルデナフィル50mg、400mg 注6) 、モキシフロキサシン400mg及びプラセボを二重盲検クロスオーバー法により単回投与した。12誘導心電図を各単回投与前に3回(30分前、15分前及び直前)及び投与後に5回(30分後、1時間後、1.5時間後、2.5時間後及び4時間後)測定した。バルデナフィルの通常臨床用量である10mg投与におけるQTcFの延長時間は平均8msec、8倍量の80mg 注5) 投与では平均10msecの延長時間であった。これらのQTcFの変化にシルデナフィルの50mg及び400mg 注6) 投与時と大きな差異は認められなかった3) (外国人データ)。 ,
薬剤
プラセボとの差(90%信頼区間)
補正前QT
延長時間
(msec)心拍数
(bpm)QTcF*
延長時間
(msec)バルデナフィル80mg 注5)
-2(-4、0)
6(5、7)
10(8、11)
バルデナフィル10mg
-2(-4、0)
5(4、6)
8(6、9)
シルデナフィル400mg 注6)
-1(-3、1)
5(4、6)
9(8、11)
シルデナフィル50mg
-2(-4、0)
4(3、5)
6(5、8)
モキシフロキサシン400mg
3(1、5)
2(1、3)
8(6、9)
※:Fridericia補正QT
18. 薬効薬理
18.1 作用機序
陰茎海綿体平滑筋及び関連小動脈を弛緩させて陰茎を勃起させるcGMPは、グアニル酸シクラーゼによる合成とPDE5による加水分解とのバランスにより調節されている。バルデナフィルはPDE5を阻害することによりcGMP量を増加させ、陰茎を勃起させる40) 。
18.2 PDE5阻害作用
バルデナフィルは強力にPDE5を阻害する。ヒト血小板、ヒト陰茎海綿体及び遺伝子組換ヒト型のPDE5に対するIC50値は、それぞれ0.7、3.4及び0.89nMであった(in vitro)41) 。
18.3 PDE5選択性
バルデナフィルはPDE5を選択的に阻害し、その作用は他のPDEsに対する作用より10~1000倍強い(in vitro)。(IC50値;PDE5:0.89nM、PDE1:121nM、PDE6:11~157nM、PDE11:308nM、PDE2、PDE3、PDE4、PDE7、PDE8、PDE9及びPDE10に対するIC50値:≧1000nM)41) 。
18.4 陰茎海綿体中cGMP増加作用
3nM以上の濃度で、NO供与体であるニトロプルシドナトリウム(SNP)1μMによるヒト摘出陰茎海綿体中cGMP濃度増加を濃度依存的に増強した(in vitro)42) 。
18.5 海綿体弛緩増強作用
ヒト摘出陰茎海綿体のSNPによる弛緩に対し、3nM以上で濃度依存的で有意な増強作用を示した(in vitro)42) 。
19. 有効成分に関する理化学的知見
一般的名称
バルデナフィル塩酸塩水和物
(Vardenafil Hydrochloride Hydrate)
化学名
1-{[3-(3,4-Dihydro-5-methyl-4-oxo-7-propylimidazo [5,1-f][1,2,4]triazin-2-yl)-4-ethoxyphenyl]sulfonyl}-4-ethylpiperazine monohydrochloride trihydrate
分子式
C23H32N6O4S・HCl・3H2O
分子量
579.11
性状
本品は⽩⾊〜微⻩⾊⼜は微褐⾊の粉末である。
本品はジメチルスルホキシド及びエタノール(99.5)に溶けやすく、⽔及びアセトニトリルにやや溶けにくい。
化学構造式
![]()
22. 包装
バルデナフィル錠5mg「FCI」:20錠[(10錠(PTP)×2)]
バルデナフィル錠10mg「FCI」:20錠[(10錠(PTP)×2)]
バルデナフィル錠20mg「FCI」:20錠[(10錠(PTP)×2)]
23. 主要文献
1) リトナビルとの相互作用試験(外国人)(レビトラ錠:2004年4月23日承認、申請資料概要ヘ.3.2.10)
2) ケトコナゾールとの相互作用試験(外国人)(レビトラ錠:2004年4月23日承認、申請資料概要ヘ.3.2.10)
3) Morganroth J, et al.: Am J Cardiol. 2004; 93: 1378-1383
4) エリスロマイシンとの相互作用試験(外国人)(レビトラ錠:2004年4月23日承認、申請資料概要ヘ.3.2.10)
5) テラゾシンとの相互作用試験(外国人)(レビトラ錠:2004年4月23日承認、申請資料概要ヘ.3.2.10)
6) タムスロシンとの相互作用試験(外国人)(レビトラ錠:2004年4月23日承認、申請資料概要ヘ.3.2.10)
7) α遮断薬との相互作用試験(外国人)(レビトラ錠:2004年4月23日承認、申請資料概要ヘ.3.2.10)
8) Auerbach SM, et al.: Urology. 2004; 64: 998-1004
9) Campbell UB, et al.: JOURNAL OF SEXUAL MEDICINE. 2015; 12: 139-151
10) Gilad R, et al.: Br Med J. 2002; 325: 869
11) Striano P, et al.: Br Med J. 2006; 333: 785
12) 吉川健一他: 臨床薬理. 2003; 34: 197S-198S
13) 薬物動態(外国人)(レビトラ錠:2004年4月23日承認、申請資料概要ヘ.3.2.4)
14) 薬物動態(外国人)(レビトラ錠:2004年4月23日承認、申請資料概要ヘ.3.2.4)
15) 社内資料:バルデナフィル錠20mg「FCI」の生物学的同等性試験
16) 薬物動態(外国人)(レビトラ錠:2004年4月23日承認、申請資料概要ヘ.3.2.1)
17) Rajagopalan P, et al.: J Clin Pharmacol. 2003; 43: 260-267
18) 血漿タンパク結合率(in vitro)(レビトラ錠:2004年4月23日承認、申請資料概要ヘ.2.2.6)
19) 薬物動態(外国人)(レビトラ錠:2004年4月23日承認、申請資料概要ヘ.3.2.6)
20) 腎障害患者における薬物動態(外国人)(レビトラ錠:2004年4月23日承認、申請資料概要ヘ.3.2.8)
21) 肝障害患者における薬物動態(外国人)(レビトラ錠:2004年4月23日承認、申請資料概要ヘ.3.2.8)
22) 高齢者における薬物動態(外国人)(レビトラ錠:2004年4月23日承認、申請資料概要ヘ.3.2.8)
23) 制酸剤との相互作用(外国人)(レビトラ錠:2004年4月23日承認、申請資料概要ヘ.3.2.10)
24) シメチジン及びラニチジンとの相互作用(外国人)(レビトラ錠:2004年4月23日承認、申請資料概要ヘ.3.2.10)
25) ジゴキシンとの相互作用(外国人)(レビトラ錠:2004年4月23日承認、申請資料概要ヘ.3.2.10)
26) ワルファリンとの相互作用(外国人)(レビトラ錠:2004年4月23日承認、申請資料概要ヘ.3.2.10)
27) グリベンクラミドとの相互作用(外国人)(レビトラ錠:2004年4月23日承認、申請資料概要ヘ.3.2.10)
28) ニフェジピンとの相互作用(外国人)(レビトラ錠:2004年4月23日承認、申請資料概要ヘ.3.2.10)
29) アスピリンとの相互作用(外国人)(レビトラ錠:2004年4月23日承認、申請資料概要ヘ.3.2.10)
30) アルコールとの相互作用(外国人)(レビトラ錠:2004年4月23日承認、申請資料概要ヘ.3.2.10)
31) 社内資料:バルデナフィル錠5mg、10mg「FCI」の生物学的同等性試験
32) 国内用量反応試験(レビトラ錠:2004年4月23日承認、申請資料概要ト.1.5.2、審査報告書)
33) Ishii N, et al.: Int J Urol. 2006; 13: 1066-1072
34) 国内第Ⅲ相臨床試験(レビトラ錠:2007年5月24日承認、審査報告書)
35) Kimoto Y, et al.: Int J Urol. 2006; 13: 1428-1433
36) 国内第Ⅲ相臨床試験(レビトラ錠:2007年5月24日承認、審査報告書)
37) 海外第Ⅲ相臨床試験(レビトラ錠:2004年4月23日承認、申請資料概要ト.1.6.1)
38) Hellstrom, W. J. et al.: J. Androl. 2002; 23: 763-771
39) 海外第Ⅲ相臨床試験(レビトラ錠:2004年4月23日承認、申請資料概要ト.1.6.2)
40) 薬効薬理(in vitro)(レビトラ錠:2004年4月23日承認、申請資料概要ホ.1)
41) 薬効薬理(in vitro)(レビトラ錠:2004年4月23日承認、申請資料概要ホ.2)
42) Saenz de Tejada I, et al.: Int J Impot Res. 2001; 13: 282-290
24. 文献請求先及び問い合わせ先
富士化学工業株式会社 学術担当
〒105-0011 東京都港区芝公園1-8-21
TEL 03-6435-6956
26. 製造販売業者等
26.1 製造販売元
富士化学工業株式会社
富山県中新川郡上市町郷柿沢1番地