スプレキュア点鼻液0.15%
作成又は改訂年月
| ** | 2022年 8月改訂 ( 第3版 ) |
| * | 2022年 4月改訂 ( 第2版 ) |
日本標準商品分類番号
薬効分類名
承認等
スプレキュア点鼻液0.15%
販売名コード
YJコード
販売名英語表記
販売名ひらがな
承認番号等
承認番号
販売開始年月
貯法・有効期間
貯法
有効期間
規制区分
処方箋医薬品 注)
注) 注意―医師等の処方箋により使用すること一般的名称
3. 組成・性状
4. 効能又は効果
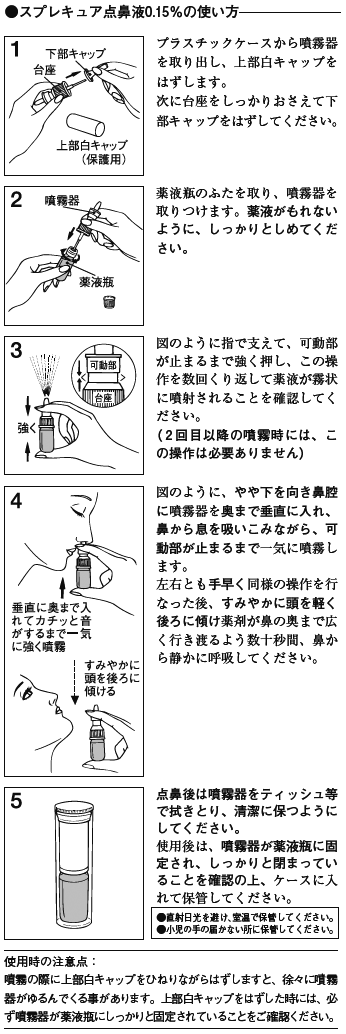
6. 用法及び用量
-
〈子宮内膜症、子宮筋腫〉
通常、成人には1回あたり左右の鼻腔に各々1噴霧(1回あたりブセレリンとして計300μg)を1日3回、月経周期1~2日目より投与する。なお、症状により適宜増減する。
-
〈中枢性思春期早発症〉
左右の鼻腔に各々1噴霧投与を1回投与(1回あたりブセレリンとして計300μg)とし、通常1日3~6回投与する。効果不十分のときは皮下注射法に切り替える。
本剤の効果は、本剤投与前と比較した投与2週以降におけるGnRHテストの血中LH、FSHの反応性の低下及び血中性ステロイドの低下で判断する。 -
〈生殖補助医療における卵胞成熟〉
左右の鼻腔に各々1噴霧投与を1回投与(1回あたりブセレリンとして計300μg)とし、通常、採卵の34~36時間前に2回投与するが、患者の反応に応じて、投与回数は1回~4回の範囲で適宜調節する。
-
〈生殖補助医療における早発排卵の防止〉
**通常、1回あたり左右の鼻腔に各々1噴霧(1回あたりブセレリンとして計300μg)を1日2~3回投与し、十分な効果が得られない場合は、1日4回投与することができる。
10. 相互作用
11. 副作用
11.1 重大な副作用
-
11.1.1 ショック、アナフィラキシー(いずれも頻度不明)
ショック、アナフィラキシー(呼吸困難、熱感、全身紅潮、血圧低下等)を起こすことがある。
- 11.1.2 うつ症状(頻度不明)
- 11.1.3 脱毛(頻度不明)
- 11.1.4 狭心症、心筋梗塞、脳梗塞(いずれも頻度不明)
- 11.1.5 血小板減少、白血球減少(いずれも頻度不明)
-
11.1.6 不正出血(頻度不明)
大量の不正出血があらわれることがある。
-
11.1.7 卵巣のう胞破裂(頻度不明)
膨満感、下腹部痛(圧痛等)等の異常が認められた場合には投与を中止し、適切な処置を行うこと。
- 11.1.8 肝機能障害、黄疸(いずれも頻度不明)
- 11.1.9 糖尿病の発症又は増悪(いずれも頻度不明)
11.2 その他の副作用
|
3%以上 |
0.1~3%未満 |
0.1%未満 |
頻度不明 |
|
|---|---|---|---|---|
|
低エストロゲン症状 |
ほてり |
リビドー減退、外陰部そう痒感、腟乾燥 |
腟炎、性交痛、視力異常、眼精疲労 |
|
|
子宮・卵巣 |
帯下 |
子宮萎縮、卵巣過剰刺激症状、卵巣のう胞 |
卵巣機能不全、卵巣過剰刺激症候群 |
|
|
乳房 |
乳房緊満 |
乳房萎縮、乳房痛 |
乳汁分泌 |
|
|
皮膚 |
痤瘡 |
爪のわれ |
多毛、皮膚乾燥 |
|
|
過敏症 |
発疹、蕁麻疹 |
湿疹、そう痒 | ||
|
消化器 |
食欲亢進、嘔気・嘔吐、腹痛、腹部膨満感、食欲減退、便秘、下痢、口渇 |
口内炎 | ||
|
肝臓 |
AST、ALT、LDH、ビリルビン上昇 |
Al-P、γ-GTP上昇 | ||
|
筋骨格系 |
肩こり |
関節痛、腰痛、頸・背部痛 |
痙攣、筋肉痛、胸痛 |
骨・四肢等の疼痛 |
|
精神神経系 |
頭痛 |
めまい、多汗、神経過敏、傾眠、不眠、しびれ感 |
嗄声、不安、健忘 |
昏迷、片頭痛 |
|
循環器 |
動悸、浮腫 |
四肢冷感、血圧上昇 | ||
|
呼吸器 |
鼻炎 |
鼻出血、呼吸困難 |
咽頭痛、喘息様症状 |
|
|
血液 |
貧血 | |||
|
その他 |
体重増加、疲労、倦怠、トリグリセライド上昇、耳鳴 |
咳、耐糖能の悪化、体重減少、悪寒、発熱、コレステロール上昇、脱力感、味覚・嗅覚異常 |
甲状腺腫大、下垂体腺腫、難聴 |
16. 薬物動態
16.1 血中濃度
-
16.1.1 単回投与
健康成人男子4例に単回(300μg)鼻腔内投与した場合、44分で最高血漿中濃度に達した。その後、半減期66分で血漿中から消失した1) 。
血漿中濃度パラメータ tmax(分)
Cmax(pg/mL)
t1/2(分)
43.8±11.8
117.3±42.5
66.0±19.5
(平均値±標準誤差、n=4)
-
16.1.2 反復投与
健康成人男子6例に1日900μg(1回300μg、1日3回)8日間反復投与した場合、第1日目と8日目では、吸収には有意差がなく蓄積性は認められなかった。
16.2 吸収
本剤は、鼻粘膜から速やかに吸収される。
16.4 代謝
本剤は、生体内成分であるGnRHと同様な酵素分解を受ける。
16.5 排泄
本剤は、尿中に排泄される。尿中排泄は、単回投与で24時間以内にブセレリン酢酸塩として1%以下であり、8日間の反復投与においても排泄量の増加は認められなかった。
17. 臨床成績
17.1 有効性及び安全性に関する試験
-
〈子宮内膜症〉
-
17.1.1 国内第2相/第3相試験
二重盲検比較試験を含む5試験において総計332例の子宮内膜症患者における総合改善率は83.4%であった。
投与量は300~1200μg/日で、投与期間は332例中255例が6ヶ月以内であった。
本剤の主な症状別の臨床効果(改善率)は次のとおりであった2) ,3) ,4) ,5) ,6) 。症状別臨床効果 症状
例数
改善以上
月経困難症
267例
244例(91.4%)
自覚総合症状
320例
296例(92.5%)
ダグラス窩の硬結
289例
241例(83.4%)
子宮可動性の制限
292例
225例(77.1%)
卵巣腫瘤
132例
101例(76.5%)
また、二重盲検比較試験において、子宮内膜症患者216例を対象に、本剤(108例)を900μg/日、1日3回噴霧投与又は対照薬ダナゾール(108例)を400μg/日、1日2回経口投与した。改善率は、本剤群81%(88/108例)及び対照薬群60%(65/108例)であった3) 。
-
17.1.1 国内第2相/第3相試験
-
〈子宮筋腫〉
-
17.1.2 国内第2相/第3相試験
二重盲検比較試験を含む5試験において総計237例の子宮筋腫患者における総合改善率は62.9%であった。
投与量は600~1200μg/日で、投与期間は237例中136例(57.4%)が4ヶ月以内であった。
本剤の主な症状別の臨床効果(改善率)及び子宮筋腫の縮小度は次のとおりであった。なお、各症状の改善は投与終了後24週まで、増加した血中Hb濃度は投与終了後8週まで値を維持した7) ,8) ,9) ,10) 。症状別臨床効果 症状
例数
改善以上
過多月経
163例
153例(93.9%)
下腹痛
138例
121例(87.7%)
腰痛
124例
113例(91.1%)
子宮筋腫縮小効果 症状
例数
縮小以上
子宮体積の縮小度
208例
109例(52.4%)
筋腫核の縮小度
112例
51例(45.5%)
また、プラセボを対照とした二重盲検比較試験において、子宮筋腫患者102例を対象に、本剤(49例)又はプラセボ(53例)を900μg/日、1日3回噴霧投与した。改善率は、本剤群66.7%(30/45例)及びプラセボ群14.0%(6/43例)であった。子宮筋腫に基づく症状の改善、子宮筋腫の縮小がみられ、安全性を総合して本剤の有用性が認められた。効果発現は、過多月経が4週以降、下腹痛が12週以降、腰痛が16週時、子宮筋腫の縮小が8週以降にプラセボと比較して有意差がみられた10) 。
-
17.1.2 国内第2相/第3相試験
-
〈中枢性思春期早発症〉
-
17.1.3 国内臨床試験
非盲検法にて4施設で実施した総計37例(最終評価時投与法:点鼻液単独13例、注射液単独20例、両剤型併用4例)において、本剤の有効性と安全性が検討された。投与量は点鼻液900~1800μg/日、注射液5.7~45.9μg/kg/日で、投与期間は8~41ヶ月であり37例中15例が3年以上であった11) 。
主要評価項目に対する改善度は「改善」「やや改善」「進行なし」「やや悪化」「悪化」で判定し、症状及び各所見の悪化が認められない「進行なし」以上を有効と判断した。副作用はみられなかった。症状
改善
やや改善
進行なし
進行なし以上
二次性徴の抑制
7例(18.9%)
17例(45.9%)
11例(29.8%)
35/37(94.6%)
内分泌に及ぼす影響
19例(51.4%)
16例(43.2%)
1例(2.7%)
36/37(97.3%)
身長増加率
14例(37.9%)
15例(40.5%)
5例(13.5%)
34/37(91.9%)
骨成熟抑制
15例(40.5%)
12例(32.5%)
4例(10.8%)
31/37(83.8%)
-
17.1.3 国内臨床試験
18. 薬効薬理
18.1 作用機序
ブセレリン酢酸塩はGnRH様作用を有し、投与初期には下垂体からのLH産生を増加させ、これにより最終的な卵胞成熟を促す。反復投与により下垂体GnRH受容体量の低下(ダウンレギュレーション)を引き起こし、下垂体のGnRH反応性を低下させ、最終的に卵巣からの性ホルモン分泌を抑制する。この下垂体―性腺系機能抑制作用により、性ホルモン依存性疾患である子宮筋腫、中枢性思春期早発症及び子宮内膜症に対する治療効果を発揮する12) 。
18.2 薬理作用(動物試験)
-
〈子宮内膜症〉
-
18.2.2 実験的子宮内膜症に対する効果
実験的子宮内膜症ラットの実験で移植子宮片によって形成された嚢胞の体積及び重量が減少し、子宮内膜症の治癒効果が認められた17) 。
-
18.2.2 実験的子宮内膜症に対する効果
- 〈生殖補助医療における卵胞成熟〉
18.3 薬理作用(臨床薬理試験)
- 〈子宮内膜症〉
-
〈子宮筋腫〉
-
18.3.3 子宮筋腫組織に対する効果
子宮筋腫患者に本剤を16週投与したとき、顕微鏡所見において子宮筋腫組織に高度のhyaline変性が認められた21) 。
-
18.3.3 子宮筋腫組織に対する効果
19. 有効成分に関する理化学的知見
一般的名称
ブセレリン酢酸塩(buserelin acetate)
化学名
5-Oxo-L-prolyl-L-histidyl-L-tryptophyl-L-seryl-L-tyrosyl-O-tert-butyl-D-seryl-L-leucyl-L-arginyl-N-ethyl-L-prolinamide monoacetate
分子式
C60H86N16O13・C2H4O2
分子量
1299.48
性状
本品は白色~微黄白色の粉末又は塊である。本品は水にやや溶けやすく、メタノール又はエタノール(95)にやや溶けにくく、ジエチルエーテルにほとんど溶けない。本品は吸湿性である。
化学構造式
H-5-oxo-Pro-His-Trp-Ser-Tyr-D-Ser(t-C4H9)-Leu-Arg-Pro-NHC2H5・CH3COOH
22. 包装
10mL 1瓶(点鼻用医薬品注入器付)
23. 主要文献
1) Saitoh, S. et al.: J. Immunol Methods. 1985 ; 79 : 173-183
2) ブセレリン研究会:産婦人科の世界. 1987 ; 39(10) : 1045-1066
3) ブセレリン研究会:産婦人科の世界. 1987 ; 39(11) : 1159-1188
4) 高見澤裕吉 他:産婦人科の世界. 1987 ; 39(8) : 793-802
5) 好川元庸 他:産婦人科の世界. 1987 ; 39(8) : 787-791
6) 古橋信晃 他:産科と婦人科. 1987 ; 54(9) : 1722-1728
7) Okamura, H. et al.: Endocrinol. Japon. 1990 ; 37(6) : 907-913
8) 中村幸雄 他:日本医事新報. 1990 ; 3450 : 23-26
9) 水口弘司 他:産婦人科の世界. 1990 ; 42(9) : 847-868
10) 水口弘司 他:産婦人科の世界. 1990 ; 42(10) : 945-964
11) Suwa, S. et al.: Acta Paediatr. Jpn. 1988 ; 30(suppl) : 176-184
12) Sandow, J.: Clin. Endocrinol. 1983 ; 18 : 571-592
13) Kerr-Wilson, R.H.J. et al.: Contraception. 1981 ; 24 : 647-655
14) Fraser, H.M. et al.: J. Clin. Endocrinol. Metab. 1985 ; 60 : 579-584
15) Sharpe, R.M. et al.: J. Endocrinol. 1979 ; 80 : 249-257
16) Sandow, J. et al.: Acta Endocrinol. 1980 ; 94 : 489-497
17) Oshima, K. et al.: Asia Pacific J. Pharmacol. 1988 ; 3 : 163-166
19) 水口弘司 他:ホルモンと臨床. 1987 ; 35 : 217-224
20) 水口弘司 他:産科と婦人科. 1987 ; 54(7) : 1395-1402
21) 植村次雄 他:Asia-Oceania J. of Obstet & Gynaecol. 1991 ; 17(4) : 315-320
24. 文献請求先及び問い合わせ先
*クリニジェン株式会社 カスタマーセンター
*〒103-0027 東京都中央区日本橋1-16-3
*TEL 0120-192-109(フリーダイヤル)
26. 製造販売業者等