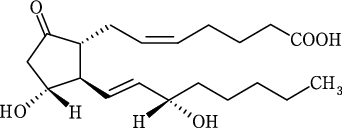
プロスタグランジンE2錠0.5mg「科研」
作成又は改訂年月
| ** | 2022年 9月改訂 ( 第2版 ) |
| * | 2020年 6月改訂 ( 第1版 ) |
日本標準商品分類番号
薬効分類名
承認等
プロスタグランジンE2錠0.5mg「科研」
販売名コード
YJコード
販売名英語表記
承認番号等
承認番号
販売開始年月
貯法・有効期間
貯法
有効期間
規制区分
劇薬
処方箋医薬品 注)
注) 注意―医師等の処方箋により使用すること一般的名称
1. 警告
-
1.1 過強陣痛や強直性子宮収縮により、胎児機能不全、子宮破裂、頸管裂傷、羊水塞栓等が起こることがあり、母体あるいは児が重篤な転帰に至った症例が報告されているので、本剤の投与にあたっては以下の事項を遵守し慎重に行うこと。,
- 1.1.1 *本剤は、分娩監視装置を用いて母体及び胎児の状態を連続モニタリングできる設備を有する医療施設において、分娩の管理についての十分な知識・経験及び本剤の安全性についての十分な知識を持つ医師のもとで使用すること。本剤の使用に先立ち、患者に本剤を用いた陣痛誘発、陣痛促進の必要性及び危険性を十分説明し、同意を得てから使用を開始すること。
- 1.1.2 母体及び胎児の状態を十分観察して、本剤の有益性及び危険性を考慮した上で、慎重に適応を判断すること。特に子宮破裂、頸管裂傷等は多産婦で起こりやすいので、注意すること。
- 1.1.3 *本剤投与中は、トイレ歩行時等、医師が必要と認めた場合に一時的に分娩監視装置を外すことを除き分娩監視装置を用いて連続的にモニタリングを行い、異常が認められた場合には、適切な処置を行うこと。なお、本剤は点滴注射剤に比べ調節性に欠けるので、慎重に投与すること。,,
- 1.1.4 *ジノプロストン(PGE2(腟用剤))との同時併用は行わないこと。また、本剤投与前に子宮頸管熟化の目的でジノプロストン(PGE2(腟用剤))を投与している場合は終了後1時間以上の間隔をあけ、十分な分娩監視を行い、慎重に投与すること。,,,
- 1.1.5 オキシトシン、ジノプロスト(PGF2α)との同時併用は行わないこと。また、前後して使用する場合も、過強陣痛を起こすおそれがあるので、前の薬剤の投与が終了した後1時間以上経過してから次の薬剤の投与を開始した上で十分な分娩監視を行い、慎重に投与すること。,,,
- 1.2 **本剤の使用にあたっては、電子添文を熟読すること。
2. 禁忌(次の患者には投与しないこと)
- 2.1 骨盤狭窄、児頭骨盤不均衡、骨盤位又は横位等の胎位異常のある患者[正常な経腟分娩が進行せず、母体及び胎児への障害を起こすおそれがある。]
- 2.2 前置胎盤の患者[出血により、母体及び胎児への障害を起こすおそれがある。]
- 2.3 常位胎盤早期剥離の患者[緊急な胎児娩出が要求されるため、外科的処置の方が確実性が高い。]
- 2.4 胎児機能不全のある患者[子宮収縮により胎児の症状を悪化させるおそれがある。]
- 2.5 帝王切開又は子宮切開等の既往歴のある患者[子宮が脆弱になっていることがあり、過強陣痛が生じると子宮破裂の危険がある。]
- 2.6 *オキシトシン、ジノプロスト(PGF2α)、ジノプロストン(PGE2(腟用剤))を投与中の患者,,
- 2.7 プラステロン硫酸(レボスパ)を投与中又は投与後十分な時間が経過していない患者[過強陣痛を起こすおそれがある。]
- 2.8 吸湿性頸管拡張材(ラミナリア等)を挿入中の患者又はメトロイリンテル挿入後1時間以上経過していない患者[過強陣痛を起こすおそれがある。]
- 2.9 *オキシトシン、ジノプロスト(PGF2α)、ジノプロストン(PGE2(腟用剤))の投与終了後1時間以上経過していない患者[過強陣痛を起こすおそれがある。],,,,
- 2.10 過強陣痛の患者[子宮破裂、胎児機能不全、胎児死亡のおそれがある。],
- 2.11 本剤の成分に対し過敏症の既往歴のある患者
3. 組成・性状
4. 効能又は効果
妊娠末期における陣痛誘発並びに陣痛促進
6. 用法及び用量
8. 重要な基本的注意
- 8.1 *本剤は点滴注射剤に比べ、調節性に欠けるので、分娩監視装置を用いた連続的なモニタリングにより子宮収縮の状態及び胎児心音の観察を行い、投与間隔を保つよう十分注意し、陣痛誘発効果、分娩進行効果を認めたときは中止し、過量投与にならないよう慎重に投与すること。,,,
- 8.2 本剤を投与する際には、Bishop score等により頸管が熟化していることを確認した後、本剤を投与することが望ましい。
- 8.3 *薬剤の使用の有無によらず、分娩時には母体の生命を脅かす緊急状態(子宮破裂、羊水塞栓、脳内出血、くも膜下出血、常位胎盤早期剥離、子癇、分娩時大量出血等)が起こることがあるため、本剤を用いた陣痛誘発、陣痛促進にあたっては、母体及び胎児の状態を十分に監視するため、分娩監視装置を用いた連続的なモニタリングの実施に加えて、定期的にバイタルサインのモニターを行うなど、患者の状態を十分に観察し、異常が認められた場合には適切な処置を行うこと。なお、分娩監視装置を用いた連続的なモニタリング中であっても、トイレ歩行時等、医師が必要と認めた場合に短時間のモニタリングの一時中断は可能であるが、長時間のモニタリングの中断は行わないこと。,
9. 特定の背景を有する患者に関する注意
10. 相互作用
10.1 併用禁忌(併用しないこと)
10.2 併用注意(併用に注意すること)
| 薬剤名等 | 臨床症状・措置方法 | 機序・危険因子 |
|---|---|---|
|
過強陣痛を起こしやすいので、ジノプロストン(腟用剤)の投与終了後1時間以上の間隔をあけ、十分な分娩監視を行い、慎重に投与すること。 |
本剤及びこれらの薬剤の有する子宮収縮作用が前後して使用することにより増強される。 |
|
|
これらの薬剤と前後して使用する場合も、過強陣痛を起こしやすいので、前の薬剤の投与が終了した後1時間以上経過してから次の薬剤の投与を開始した上で十分な分娩監視を行い、慎重に投与すること。 |
本剤及びこれらの薬剤の有する子宮収縮作用が前後して使用することにより増強される。 |
11. 副作用
14. 適用上の注意
16. 薬物動態
17. 臨床成績
17.1 有効性及び安全性に関する試験
-
17.1.1 国内一般臨床試験
一般臨床試験(526例)の概要は次のとおりである3) ,4) ,5) ,6) ,7) ,8) ,9) ,10) ,11) 。
-
17.1.2 国内第Ⅲ相試験
二重盲検比較試験(100例)の概要は次のとおりである12) 。
陣痛のまったくみられない症例で、本剤により陣痛が発来したと認められたもの 注3) は、初産婦で66.7%(32/48例)、経産婦で67.3%(35/52例)であった。また、本剤により分娩進行が確認されたと認められたもの 注4) は、初産婦で52.1%(25/48例)、経産婦で59.6%(31/52例)であった。
総合効果(症例の背景因子、分娩誘発効果、分娩進行効果及び投与開始から分娩終了までの時間を総合した評価)での有効率は初産婦で41.7%(20/48例)、経産婦で46.2%(24/52例)であった。やや有効以上は初産婦で75.0%(36/48例)、経産婦で82.7%(43/52例)であった。
副作用発現頻度は、母体16.0%(16/100例)、胎児8.0%(8/100例)であった。主な副作用は、母体では嘔気・嘔吐6.0%(6/100例)、胎児では羊水混濁5.0%(5/100例)であった。注3) 1周期10分以内の規則的な子宮収縮が投与開始後6時間以内に発来したもの。注4) Bishop scoreの2点以上の上昇が投与開始後6時間以内に確認されたもの。
18. 薬効薬理
18.1 作用機序
プロスタグランジンE2は子宮平滑筋プロスタグランジンE2受容体に作用し、細胞内遊離Ca2+濃度を増加させ、子宮平滑筋の収縮をもたらすと考えられる。
また、プロスタグランジンE2は子宮頸管を構成する繊維芽細胞に作用し、マトリックスメタロプロテアーゼやヒアルロン酸合成酵素産生の増加を促し、細胞外マトリックスを変化させることで頸管熟化(軟化)作用を示すと考えられる。
18.3 頸管軟化作用
分娩誘発に際し頸管軟化作用などの内診所見改善作用を有する12) (ヒト)。
19. 有効成分に関する理化学的知見
22. 包装
60錠[10錠(PTP)×6]
23. 主要文献
1) 社内資料:KPEの吸収、分布、代謝および排泄に関する試験(Ⅲ)
2) 丹治昭治 他:薬理と治療. 1981;9:1431-1451
3) 田中俊誠 他:臨床婦人科産科. 1980;34:315-320
4) 経塚光夫 他:産婦人科の世界. 1980;32:103-111
5) 中山陽比古 他:産婦人科の世界. 1979;31:1379-1383
6) 浜田哲郎 他:産婦人科の世界. 1980;32:615-618
7) 永井生司:産婦人科の世界. 1980;32:609-614
8) 麻生武志 他:産科と婦人科. 1980;47:1024-1029
9) 倉智敬一 他:産婦人科治療. 1980;41:115-121
10) 林谷誠治 他:産婦中四会誌. 1980;28:37-43
11) 坂元力 他:産婦人科の世界. 1980;32:1333-1338
12) 鈴木雅洲 他:産婦人科の世界. 1981;33:177-190
24. 文献請求先及び問い合わせ先
富士製薬工業株式会社 富山工場 学術情報課
〒939-3515 富山県富山市水橋辻ヶ堂1515番地
(TEL)0120-956-792
(FAX)076-478-0336
26. 製造販売業者等
26.1 製造販売元
科研製薬株式会社
東京都文京区本駒込二丁目28番8号
26.2 発売元
富士製薬工業株式会社
富山県富山市水橋辻ヶ堂1515番地