コレアジン錠12.5㎎
作成又は改訂年月
| 2021年 6月改訂 ( 第1版 ) |
日本標準商品分類番号
薬効分類名
承認等
コレアジン錠12.5㎎
販売名コード
YJコード
販売名英語表記
販売名ひらがな
承認番号等
承認番号
販売開始年月
貯法・有効期間
貯法
有効期間
規制区分
劇薬
処方箋医薬品 注)
注) 注意―医師等の処方箋により使用すること一般的名称
3. 組成・性状
4. 効能又は効果
ハンチントン病に伴う舞踏運動
5. 効能又は効果に関連する注意
本剤の効果はハンチントン病に伴う舞踏運動の改善に限定されており、舞踏運動以外の症状改善は期待できないことに留意すること。
6. 用法及び用量
通常、成人にはテトラベナジンとして1日量12.5mg(12.5mgの1日1回投与)から経口投与を開始し、以後症状を観察しながら1週毎に1日量として12.5mgずつ増量し、維持量を定める。その後は、症状により適宜増減するが、1日最高投与量は100mgとする。
なお、1日量が25mgの場合は1日2回、1日量が37.5mg以上の場合には1日3回に分けて投与することとし、1回最高投与量は37.5mgとする。
7. 用法及び用量に関連する注意
- 7.1 投与は「用法及び用量」に従い低用量から始め、抑うつ症状、アカシジア及びパーキンソニズム等の発現について観察を十分に行い、忍容性をみながら慎重に増量し、患者ごとに適切な維持量を定めること。,,,,,
- 7.2 CYP2D6阻害作用を有する薬剤を投与中の患者又は遺伝的にCYP2D6の活性が欠損している患者(Poor Metabolizer)又はCYP2D6の活性が低い患者(Intermediate Metabolizer)では、本剤の活性代謝物の血中濃度が上昇し、副作用が発現しやすいおそれがあるため、投与に際しては、忍容性に問題がない場合にのみ徐々に増量する等、患者の状態を注意深く観察し、慎重に投与すること。,,,
8. 重要な基本的注意
- 8.1 本剤の投与によりうつ病・うつ状態の発現又は悪化、また、認知機能の悪化があらわれることがあるので、本剤の投与に際しては、患者及びその家族等に対し十分に説明を行うとともに、治療上の有益性が危険性を上回っていることを常に確認し、投与の継続が適切であるかどうかを定期的に判断すること。,,,,,,
- 8.2 うつ病・うつ状態、自殺念慮、自殺企図等の精神症状があらわれることがあるので、関連する症状があらわれた場合には、本剤の減量又は投与を中止するなど適切な処置を行うこと。,,,,,,
- 8.3 患者及びその家族等にうつ病・うつ状態の発現又は悪化、自殺念慮や自殺企図、攻撃性、易刺激性等の行動の変化があらわれることのリスク等について十分説明を行い、医師と緊密に連絡を取り合うよう指導すること。,,,,,,
- 8.4 アカシジア及びパーキンソニズム等があらわれることがあるので、症状があらわれた場合には、本剤の減量又は投与を中止するなど適切な処置を行うこと。
- 8.5 プロラクチン上昇があらわれることがあるので、月経異常、乳汁漏出又は性欲減退等が認められた場合には、本剤の減量又は投与を中止するなど適切な処置を行うこと。
- 8.6 嚥下障害が発現又は悪化するおそれがあり、肺炎、気管支炎に至ることがあるので、観察を十分に行い、このような症状があらわれた場合には、適切な処置を行うこと。
- 8.7 鎮静、傾眠等があらわれることがあるので、本剤投与中の患者には自動車の運転等、危険を伴う機械の操作に従事させないよう注意すること。
9. 特定の背景を有する患者に関する注意
9.1 合併症・既往歴等のある患者
- 9.1.1 うつ病・うつ状態又はその既往のある患者、自殺念慮又は自殺企図の既往のある患者
- 9.1.2 QT延長のある患者(先天性QT延長症候群等)、QT延長を起こしやすい患者(著明な徐脈等の不整脈又はその既往のある患者、低カリウム血症又は低マグネシウム血症のある患者等)
- 9.1.3 脱水・栄養不良状態等を伴う身体的疲弊のある患者
-
9.1.4 遺伝的にCYP2D6の活性が欠損している患者(Poor Metabolizer)又はCYP2D6の活性が低い患者(Intermediate Metabolizer)
投与に際しては、忍容性に問題がない場合にのみ徐々に増量する等、患者の状態を注意深く観察し、慎重に投与すること。本剤の活性代謝物の血中濃度が上昇し、副作用が発現しやすいおそれがある。,,
9.3 肝機能障害患者
9.5 妊婦
妊婦又は妊娠している可能性のある女性には、治療上の有益性が危険性を上回ると判断される場合にのみ投与すること。
9.6 授乳婦
治療上の有益性及び母乳栄養の有益性を考慮し、授乳の継続又は中止を検討すること。
9.7 小児等
小児等を対象とした臨床試験は実施していない。
9.8 高齢者
一般に生理機能が低下していることが多い。
10. 相互作用
10.1 併用禁忌(併用しないこと)
10.2 併用注意(併用に注意すること)
| 薬剤名等 | 臨床症状・措置方法 | 機序・危険因子 |
|---|---|---|
|
本剤の活性代謝物の血中濃度が上昇することがあるので、本剤を減量するなど考慮すること。 |
これらの薬剤の薬物代謝酵素阻害作用による。 |
|
|
QT間隔延長、心室性不整脈(Torsade de pointesを含む)等の重篤な副作用を起こすおそれがある。 |
いずれもQT間隔を延長させるおそれがある。 |
|
|
レボドパ |
相互に作用を減弱することがある。 |
本剤はモノアミン涸渇作用を有していることから、ドパミン作動性神経において作用が拮抗する可能性がある。 |
|
相互に作用を増強することがある。 |
本剤はモノアミン涸渇作用を有していることから、併用により作用が増強されるおそれがある。 |
|
|
降圧剤 |
起立性低血圧等を起こすおそれがある。 |
降圧剤の作用を増強する可能性がある。 |
|
アルコール |
相互に作用を増強することがある。 |
併用により作用が増強されたり、鎮静及び傾眠を悪化させるおそれがある。 |
11. 副作用
11.1 重大な副作用
11.2 その他の副作用
|
5%以上 |
5%未満 |
頻度不明 |
|
|---|---|---|---|
|
過敏症 |
―― |
―― |
発疹、そう痒 |
|
精神神経系 |
傾眠(26.1%)、パーキンソニズム、アカシジア、不眠症、睡眠障害、落ち着きのなさ、気力低下、鎮静 |
怒り、頭痛、すくみ現象、認知障害 |
激越、不安、錯乱、失見当識、神経過敏、平衡障害、運動緩慢、めまい、ジストニー、振戦 |
|
消化器 |
便秘(21.7%) |
―― |
下痢、口渇、嚥下障害、悪心・嘔吐、流涎過多 |
|
肝 臓 |
AST上昇、ALT上昇、γ-GTP上昇、LDH上昇 |
―― |
―― |
|
腎 臓 |
―― |
クレアチニン上昇 |
―― |
|
内分泌 |
プロラクチン上昇(39.1%) |
月経異常 |
―― |
|
血 液 |
―― |
血小板数減少 |
―― |
|
その他 |
CK上昇、疼痛、体重増加 |
熱感、転倒、体重減少 |
疲労 |
13. 過量投与
14. 適用上の注意
15. その他の注意
16. 薬物動態
16.1 血中濃度
-
16.1.1 単回投与
健康成人男子17例にテトラベナジン(TBZ)12.5、25及び50mg注1)を空腹時単回経口投与したとき、テトラベナジンは速やかに吸収され、投与0.6~0.7時間後に最高血漿中濃度(Cmax)に達し、投与後4時間以降は血漿中より検出されなかった。循環血液中の活性代謝物であるα-HTBZ及びβ-HTBZ並びに主要代謝物である9-デスメチルβ-HTBZはそれぞれ投与0.8~1.3時間後、1.1~1.3時間後及び1.3~1.7時間後にCmaxに達した。これら代謝物のCmax及びAUC0-∞には用量直線性が認められた1) 。
投与量
(mg)例数
測定対象
Cmax
(ng/mL)Tmax
(hr)t1/2
(hr)AUC0-∞
(ng・hr/mL)12.5
6
TBZa)
0.6±0.4
0.7±0.3b)
0.7c)
1.7c)
α-HTBZ
21.4±7.6
1.3±0.4
4.9±1.5
96.4±58.2
β-HTBZ
12.4±9.4
1.3±0.6
3.2±1.7
42.7±49.4
9-デスメチル
β-HTBZ7.8±2.6
1.6±0.5
12.5±2.3
92.9±18.0
25
6
TBZa)
1.3±1.6
0.7±0.3b)
0.7±0.2d)
3.3±2.3d)
α-HTBZ
48.8±7.3
1.2±0.3
5.2±0.8
214.7±49.6
β-HTBZ
29.7±14.6
1.3±0.3
3.7±1.4
85.7±39.4
9-デスメチル
β-HTBZ17.2±2.5
1.7±0.5
11.1±1.8
198.8±29.6
50
5
TBZa)
3.6±3.4
0.6±0.2
1.1±0.3
4.3±3.3
α-HTBZ
92.3±10.6
0.8±0.3
4.5±0.9
341.7±81.9
β-HTBZ
45.2±9.5
1.1±0.2
3.8±1.2
119.9±32.8
9-デスメチル
β-HTBZ40.1±9.6
1.3±0.3
9.5±0.7
379.9±28.8
平均値±標準偏差
a:参考値、b:5例、c:1例、d:3例 -
16.1.2 反復投与
健康成人24例(外国人)にテトラベナジン25mgを空腹時1日1回5日間反復経口投与したとき、血漿中HTBZ(α-HTBZとβ-HTBZ)濃度が定常状態にあると予測される5日目のAUC0-24(551.64±738.62ng・hr/mL)は、1日目のAUC0-∞(538.37±828.47ng・hr/mL)の約1.1倍であった。t1/2は1日目及び5日目でそれぞれ約5.4時間及び約6.4時間であり、大きな違いは認められなかった2) 。
-
16.1.3 食事の影響
健康成人25例(外国人)にテトラベナジン25mgを空腹時あるいは高脂肪高カロリー食摂取30分後に単回経口投与したとき、α-HTBZ及びβ-HTBZのCmax及びAUCに顕著な差はなく、食事の影響は認められなかった3) 。
Cmax
(ng/mL)Tmaxa)
(hr)t1/2
(hr)AUC0-t
(ng・hr/mL)AUC0-∞
(ng・hr/mL)α-HTBZ
空腹時
32.2±13.0
1.00
6.82±2.42b)
175±76.4
196±97.5b)
食後
30.6±10.0
2.00
5.98±1.83
197±83.9
215±105
β-HTBZ
空腹時
18.4±14.1
1.50
3.40±2.10c)
89.5±105
102±134c)
食後
17.5±12.1
2.50
3.50±1.76b)
97.8±114
107±146b)
平均値±標準偏差
a:中央値、b:23例、c:22例注1)本剤の承認された1回最高投与量は37.5mgである。
16.3 分布
16.4 代謝
テトラベナジンはカルボニル還元酵素により活性代謝物であるα-HTBZ及びβ-HTBZへ代謝される。その他、チトクロームP450(CYP1A2)等で水酸化やデスメチル化を受けることが示唆されている6) 。α-HTBZは、CYP2D6及びCYP1A2により9-デスメチルα-HTBZと10-デスメチルα-HTBZへ代謝され、一部はCYP3A4の代謝を受けることが示唆された。β-HTBZはCYP2D6により9-デスメチルβ-HTBZや10-デスメチルβ-HTBZ等に代謝され、一部はCYP3A4による水酸化を受けることが示唆された6) 。テトラベナジンを投与されたヒトの血漿中及び尿中には、これらの代謝物の硫酸抱合体やグルクロン酸抱合体が存在することが確認された7) 。,
16.5 排泄
16.6 特定の背景を有する患者
-
16.6.1 CYP2D6遺伝子多型
健康成人男子17例にテトラベナジン12.5、25及び50mg注1)を空腹時単回経口投与したとき、CYP2D6のIntermediate Metabolizer(IM)におけるα-HTBZ及びβ-HTBZのCmax及びAUC0-∞はExtensive Metabolizer(EM)よりいずれも高値を示し、9-デスメチルβ-HTBZのCmax及びAUC0-∞は低値を示した。血漿中α-HTBZ、β-HTBZ及び9-デスメチルβ-HTBZ濃度はCYP2D6表現型によって影響されることが示唆された1) 。,,,
TBZ投与量
(mg)CYP2D6
表現型例数
Cmax
(ng/mL)Tmax
(hr)t1/2
(hr)AUC0-∞
(ng・hr/mL)α-HTBZ
12.5
EM
5
19.0±5.4
1.3±0.4
4.5±1.2
75.2±29.4
IM
1
33.2
1.0
7.1
202.4
25
EM
5
46.8±6.0
1.2±0.3
4.9±0.5
204.2±47.5
IM
1
59.1
1.0
6.5
267.1
50
EM
5
92.3±10.6
0.8±0.3
4.5±0.9
341.7±81.9
β-HTBZ
12.5
EM
5
9.0±5.1
1.4±0.7
2.5±0.9
23.0±12.5
IM
1
29.2
1.0
6.2
141.0
25
EM
5
24.1±5.1
1.3±0.3
3.5±1.5
71.2±19.2
IM
1
58.0
1.0
4.5
158.2
50
EM
5
45.2±9.5
1.1±0.2
3.8±1.2
119.9±32.8
9-デスメチルβ-HTBZ
12.5
EM
5
8.6±1.7
1.6±0.5
11.7±1.4
95.1±19.3
IM
1
3.6
1.5
16.3
82.1
25
EM
5
17.9±2.0
1.8±0.4
10.6±1.3
205.2±28.1
IM
1
13.4
1.0
13.9
166.9
50
EM
5
40.1±9.6
1.3±0.3
9.5±0.7
379.9±28.8
平均値±標準偏差
TBZ50mg投与群のIM(1例)は薬物動態解析除外例注1)本剤の承認された1回最高投与量は37.5mgである。
- 16.6.2 腎機能障害患者
-
16.6.3 肝機能障害患者
軽度又は中等度の肝機能障害(Child-Pughスコア:5~9)患者及び健康成人各12例(外国人)に、テトラベナジン25mgを空腹時単回経口投与したとき、健康成人では多くの測定時点において血漿中のテトラベナジンは定量限界未満であったのに対して、肝機能障害患者ではテトラベナジンのCmaxは43.8ng/mLを示し、活性代謝物(α-HTBZとβ-HTBZ)のTmax及びt1/2は健康成人に比べて延長し、AUC0-tは増加した。また、肝機能障害患者では、Child-Pughスコアの増加に伴ってテトラベナジン及び活性代謝物(α-HTBZとβ-HTBZ)のAUC0-tは増加し、t1/2は延長した8) 。,,
Cmax
(ng/mL)Tmaxa)
(hr)t1/2
(hr)AUC0-t
(ng・hr/mL)TBZ
健康成人b)
-
-
-
-
肝機能障害患者
43.8±35.3c)
1.00c)
17.5±7.81d)
151±109c)
α-HTBZ
健康成人
35.0±11.2
1.00
6.10±2.40
182±96.0
肝機能障害患者
30.5±15.0
1.75
10.1±5.53e)
247±114
β-HTBZ
健康成人
18.8±9.83
1.00
3.68±1.43
81.6±71.2
肝機能障害患者
17.4±12.8
1.75
8.42±6.09d)
107±51.7
平均値±標準偏差
a:中央値、b:多くの測定時点において定量限界未満であり算出できず、c:9例、d:8例、e:11例
16.7 薬物相互作用
-
16.7.1 薬剤トランスポータ(P-糖蛋白質)に関連した相互作用
健康成人12例(外国人)に、テトラベナジン50mg注1)とP-糖蛋白質の基質であるジゴキシン0.25mgを併用したとき、テトラベナジンはジゴキシンの薬物動態に影響を与えなかった9) 。
In vitro試験から、テトラベナジン及びα-HTBZはP-糖蛋白質の基質ではないが、β-HTBZは基質であることが示唆された10) 。 -
16.7.2 CYP2D6阻害薬との相互作用
健康成人30例(外国人)に、強力なCYP2D6阻害薬であるパロキセチン20mgの反復投与時(血漿中濃度が定常状態のとき)にテトラベナジン50mg注1)を併用投与したとき、テトラベナジンを単独投与したときに比べ、α-HTBZ及びβ-HTBZのCmaxはそれぞれ約1.4倍、約2.4倍に、AUC0-∞はそれぞれ約3.2倍、約8.9倍に増加した。t1/2は、α-HTBZで約2倍、β-HTBZで約3倍遅延した11) 。 ,,,
注1)本剤の承認された1回最高投与量は37.5mgである。
17. 臨床成績
17.1 有効性及び安全性に関する試験
-
17.1.1 国内第Ⅲ相試験
-
(1) 非盲検試験(短期投与試験)
ハンチントン病患者23例を対象にテトラベナジン12.5mg~100mg/日を1日1~3回(経口)で12週間(8週間は漸増法による用量設定期)投与した結果、投与後におけるUHDRS(ハンチントン病統一評価尺度)のTCS(舞踏運動合計スコア)におけるベースライン(16.5±4.8)からの変化量(平均値±標準偏差)は、-9.7±4.8であり、海外試験から想定されたプラセボの変化量(-1.13)に比し有意に減少した。
副作用発現頻度は73.9%(17例/23例)であり、主な副作用は、不眠症、パーキンソニズム、傾眠、便秘各13.0%(3例/23例)であった12) 。TCSのベースラインからの変化量 例数
平均値±標準偏差
95%信頼区間
p値a)
23
-9.7±4.8
-11.7~-7.6
<0.0001
a:帰無仮説を「-1.13」としたt分布に基づく一標本の検定
-
(2) 非盲検試験(長期継続投与試験)
短期投与試験を終了したハンチントン病患者19例を対象に実施した長期継続投与試験の結果、UHDRSのTCSにおけるベースライン(17.2±5.0)からの変化量(平均値±標準偏差)は、それぞれ24週で-11.1±4.5、48週で-11.9±5.4であり、効果は48週目まで維持された。副作用発現頻度は73.7%(14例/19例)であり、主な副作用は、血中プロラクチン増加26.3%(5例/19例)、傾眠及び便秘各15.8%(3例/19例)、血中LDH増加及び尿中血陽性10.5%(2例/19例)であった13) 。
TCSのベースラインからの変化量 評価時期
例数
平均値±標準偏差
95%信頼区間
12週
19
-11.1±3.7
-12.9~-9.2
16週
19
-11.5±4.7
-13.8~-9.3
24週
19
-11.1±4.5
-13.3~-8.9
32週
19
-11.1±5.4
-13.7~-8.5
40週
17
-11.8±4.9
-14.3~-9.3
48週
17
-11.9±5.4
-14.7~-9.1
-
(1) 非盲検試験(短期投与試験)
-
17.1.2 海外第Ⅲ相試験
-
(1) プラセボ対照無作為化二重盲検並行群間比較試験(米国)
ハンチントン病患者84例を対象にテトラベナジン12.5mg~100mg/日又はプラセボを1日1~3回(経口)で12週間(7週間は漸増法による用量設定期)投与した結果、UHDRSのTCSにおけるベースラインからの平均変化量(最小二乗平均値±標準誤差)は、テトラベナジン群で-5.04±0.49、プラセボ群で-1.52±0.67であり、テトラベナジン群ではプラセボ群に比し有意に減少した。UHDRSの機能評価(Part Ⅳ)において、テトラベナジン群ではプラセボ群に比し有意な悪化がみられたが、臨床上問題となる変化ではなかった。
副作用発現頻度は、テトラベナジン群は85.2%(46例/54例)、プラセボ群は46.7%(14例/30例)であり、テトラベナジン群の主な副作用は、疲労20.4%(11例/54例)、不眠症18.5%(10例/54例)、傾眠16.7%(9例/54例)、うつ病、鎮静、転倒各14.8%(8例/54例)、悪心13.0%(7例/54例)、不安11.1%(6例/54例)等であった14) 。TCSのベースラインからの平均変化量 群
例数
推定値±標準誤差
95%信頼区間
p値a)
TBZ
54
-5.04±0.49
-6.02~-4.07
<0.0001
プラセボ
30
-1.52±0.67
-2.86~-0.19
群間差
-3.52±0.82
-5.15~-1.89
注:欠測値は最終評価値を用いて補填した。
a:投与群及び施設を要因、ベースライン値を共変量とした共分散分析 -
(2) 非盲検非対照長期投与試験(米国)
ハンチントン病患者75例を対象にテトラベナジン12.5mg~200mg/日注1)を1日1~3回(経口)で80週間(11週間は漸増法による用量設定期)投与した結果、UHDRSのTCSにおけるベースライン(14.95±3.67)からの変化量(平均値±標準偏差)は、それぞれ投与24週で-5.75±4.98、48週で-5.49±5.44、80週で-4.60±5.55であり、いずれの評価時期においてもベースラインに比し、有意な減少が認められた。81週は離脱期(テトラベナジン未服用)であり、TCSは服用前のベースライン値とほぼ同程度まで増加した。
副作用発現頻度は94.7%(71例/75例)であり、主な副作用は、鎮静40.0%(30例/75例)、うつ病28.0%(21例/75例)、不眠症26.7%(20例/75例)、不安25.3%(19例/75例)、アカシジア、転倒各20.0%(15例/75例)等であった15) 。TCSのベースラインからの変化量 評価時期
例数
平均値±標準偏差
95%信頼区間
p値a)
2週
73
-3.60±3.07
-4.32~-2.89
<0.0001
6週
74
-5.09±4.13
-6.05~-4.14
<0.0001
12週
73
-5.78±3.69
-6.64~-4.92
<0.0001
24週
72
-5.75±4.98
-6.92~-4.58
<0.0001
36週
58
-6.12±4.61
-7.33~-4.91
<0.0001
48週
57
-5.49±5.44
-6.93~-4.05
<0.0001
64週
12
-5.92±5.09
-9.15~-2.68
0.0020
80週
45
-4.60±5.55
-6.27~-2.93
<0.0001
81週
(離脱期)41
-0.17±4.82
-1.69~1.35
0.8216
a:paired t-test
注1)本剤の承認された1日最高投与量は100mgである。
-
(1) プラセボ対照無作為化二重盲検並行群間比較試験(米国)
17.3 その他
-
17.3.1 QTc間隔に及ぼす影響
健康成人51例(外国人)に、テトラベナジン25、50mg注1)、モキシフロキサシン400mg又はプラセボを空腹時に単回経口投与したとき、投与後2.5時間における、QTcI間隔の時間を一致させたベースラインからの変化量のプラセボとの差はモキシフロキサシン400mg投与時で12.5msec延長したのに対し、テトラベナジン25mg及び50mg投与時ではそれぞれ3.6msec及び7.7msec延長した。また、50mg投与時の90%信頼区間の上限は10.4msecであり、10msecを上回っていたことから、テトラベナジンはモキシフロキサシンと比較して程度は小さいものの、QTc間隔を延長する可能性が示唆された16) 。
注1)本剤の承認された1回最高投与量は37.5mgである。
18. 薬効薬理
18.1 作用機序
テトラベナジンは中枢神経系前シナプスにおいて、モノアミン小胞トランスポーター2(VMAT2)を選択的に阻害することにより、神経終末のモノアミン類(ドパミン、セロトニン、ノルアドレナリン)を涸渇させる。テトラベナジンの抗舞踏運動作用は主としてハンチントン病の主病変部位である線条体においてドパミンを涸渇することによるものであると推察される。テトラベナジンの活性代謝物であるα-HTBZ及びβ-HTBZも、テトラベナジンと同程度のヒトVMAT2阻害作用を示した。
テトラベナジンは、ラット脳内(視床下部、前頭皮質、線条体)のモノアミンを涸渇し、その作用は2時間持続した。モノアミン涸渇作用は線条体ドパミンに対して最も選択性が高かった17)
。
HTBZは、ウシ副腎髄質クロム親和性顆粒細胞膜上の[3H]-HTBZ結合部位に対して、テトラベナジンと同程度の親和性及び選択性を示した18)
,19)
。また、ヒト脳において、黒質緻密部、青斑核、背側縫線核での結合が高かった20)
。
19. 有効成分に関する理化学的知見
一般的名称
テトラベナジン(Tetrabenazine)
化学名
9,10-dimethoxy-3-(2-methylpropyl)-1,3,4,6,7,11b-hexahydrobenzo[a]quinolizin-2-one
分子式
C19H27NO3
分子量
317.42
性状
白色~微黄色の粉末である。
化学構造式
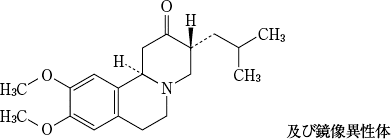
融点
127~131℃
20. 取扱い上の注意
PTP包装開封後は遮光して保存すること。
21. 承認条件
国内での治験症例が極めて限られていることから、製造販売後、一定数の症例にかかるデータが集積されるまでの間は、全症例を対象とした使用成績調査を実施することにより、本剤使用患者の背景情報を把握するとともに、本剤の安全性及び有効性に関するデータを早期に収集し、本剤の適正使用に必要な措置を講じること。
22. 包装
100錠[10錠(PTP)×10]
23. 主要文献
1) 社内資料:国内第Ⅰ相単回投与時の薬物動態に関する資料(2012年12月25日承認、CTD2.7.2.2.2.1.1)
2) 社内資料:テトラベナジンの単回及び反復経口投与による薬物動態試験に関する資料(2012年12月25日承認、CTD2.7.2.2.2.1.2)
3) 社内資料:テトラベナジンの薬物動態に対する食事の影響に関する資料(2012年12月25日承認、CTD2.7.1.2.1)
4) 社内資料:テトラベナジンの血漿蛋白結合率に関する資料(2012年12月25日承認、CTD2.7.2.2.1.1)
5) 社内資料:テトラベナジンの組織内分布に関する資料(2012年12月25日承認、CTD2.6.4.4.2)
6) 社内資料:テトラベナジンの代謝に関する資料(2012年12月25日承認、CTD2.7.2.2.1.4,2.7.2.2.2.1.5)
7) 社内資料:マスバランス試験に関する資料(2012年12月25日承認、CTD2.7.2.2.2.1.2)
8) 社内資料:肝機能障害患者における薬物動態試験に関する資料(2012年12月25日承認、CTD2.7.2.2.2.3.1)
9) 社内資料:ジゴキシンとの併用時の薬物相互作用に関する資料(2012年12月25日承認、CTD2.7.2.2.2.4.1)
10) 社内資料:P-糖蛋白質試験に関する資料(2012年12月25日承認、CTD2.6.4.7.1)
11) 社内資料:パロキセチン反復併用時の相互作用に関する資料(2012年12月25日承認、CTD2.7.2.2.2.4.2)
12) 社内資料:ハンチントン病患者を対象とした国内第Ⅲ相試験(短期投与試験)に関する資料(2012年12月25日承認、CTD.2.7.6.16)
13) 社内資料:ハンチントン病患者を対象とした国内第Ⅲ相試験(長期投与試験)に関する資料
14) Huntington Study Group:Neurology.2006;66(3):366-372
15) Frank S.:BMC Neurol.2009;9:62-71
16) 社内資料:QT/QTc間隔に及ぼす影響に関する資料(2012年12月25日承認、CTD2.7.2.2.2.5.2)
17) Pettibone, DJ. et al.:Eur J Pharmacol.1984;102(3-4):425-430
18) Scherman, D. et al.:Proc Natl Acad Sci USA.1983;80(2):584-588
19) Scherman, D. et al.:Mol Pharmacol.1988;33:72-77
20) Thibaut, F. et al.:Brain Res.1995;692(1-2):233-243
24. 文献請求先及び問い合わせ先
アルフレッサ ファーマ株式会社 製品情報部
〒540-8575 大阪市中央区石町二丁目2番9号
TEL 06-6941-0306 FAX 06-6943-8212
26. 製造販売業者等
26.1 製造販売元
アルフレッサ ファーマ株式会社
大阪市中央区石町二丁目2番9号