ミダフレッサ静注0.1%
作成又は改訂年月
| * | 2021年 9月改訂 ( 第1版 、 用法変更、用量変更 ) |
日本標準商品分類番号
薬効分類名
承認等
一般的名称
3. 組成・性状
4. 効能又は効果
てんかん重積状態
6. 用法及び用量
-
*〈静脈内投与〉
通常、修正在胎45週以上(在胎週数+出生後週数)の小児及び成人には、ミダゾラムとして0.15mg/kgを静脈内投与し、必要に応じて1回につき0.1~0.3mg/kgの範囲で追加投与するが、患者の状態に応じて適宜増減する。ただし、初回投与と追加投与の総量として0.6mg/kgを超えないこと。投与速度は1mg/分を目安とすること。
-
*〈持続静脈内投与〉
通常、修正在胎45週以上(在胎週数+出生後週数)の小児及び成人には、ミダゾラムとして0.1mg/kg/時より持続静脈内投与を開始し、必要に応じて0.05~0.1mg/kg/時ずつ増量するが、患者の状態に応じて適宜増減する。最大投与量は0.4mg/kg/時までとすること。
7. 用法及び用量に関連する注意
8. 重要な基本的注意
9. 特定の背景を有する患者に関する注意
9.1 合併症・既往歴等のある患者
- 9.1.1 高度重症患者、呼吸予備力の制限されている患者
- 9.1.2 衰弱患者
- 9.1.3 脳に器質的障害のある患者
-
9.1.4 重症心不全等の心疾患のある患者
患者の状態を観察しながら少量から投与を開始するなど、慎重に投与すること。作用が強くあらわれるおそれがある。また、必ず動脈圧及び心電図をモニターし、昇圧剤等の蘇生に必要な薬剤を準備したうえで使用すること。本剤の投与により症状の悪化又は急激な血圧低下を来すことがある。,,
-
9.1.5 重症の水分又は電解質障害のある急性期患者
十分な補液・輸液が行われるまで本剤の投与を行わないこと。脱水等により体液が不足している患者では、本剤の投与により血圧低下を来しやすい。
- 9.1.6 アルコール又は薬物乱用の既往のある患者
- 9.1.7 睡眠時無呼吸症候群の患者
9.5 妊婦
- 妊婦又は妊娠している可能性のある女性には治療上の有益性が危険性を上回ると判断される場合にのみ投与すること。妊娠中の投与に関し、次のような報告がある。,
- 妊娠中に他のベンゾジアゼピン系薬剤の投与を受け、出生した新生児に口唇裂(口蓋裂を伴うものを含む)等が対照群と比較して有意に多いとの疫学的調査報告がある。
- 妊娠末期の妊婦へ投与又は分娩中の患者に高用量を投与したとき、胎児に心拍数の不整、新生児に低血圧、哺乳困難、低体温、呼吸抑制があらわれたとの報告がある。なお、ベンゾジアゼピン系薬剤で新生児に哺乳困難、嘔吐、活動低下、筋緊張低下、過緊張、嗜眠、傾眠、呼吸抑制・無呼吸、チアノーゼ、易刺激性、神経過敏、振戦、低体温、頻脈等を起こすことが報告されており、これらの症状は、離脱症状あるいは新生児仮死として報告される場合もある。また、ベンゾジアゼピン系薬剤で新生児に黄疸の増強を起こすことが報告されている。
- 分娩前に連用した場合、出産後新生児に離脱症状があらわれることが、ベンゾジアゼピン系薬剤で報告されている。
9.7 小児等
- 9.7.1 低出生体重児及び新生児に対して急速静脈内投与をしてはならない。急速静脈内投与後、重度の低血圧及び痙攣発作が報告されている。,
- 9.7.2 幼児では小児より、小児では成人より高用量を必要とすることがあり、より頻繁な観察が必要である。成人に比べて幼児及び小児における本剤の血中消失半減期は同等又は短いことが報告されている。,
- 9.7.3 低出生体重児及び新生児では小児よりも投与量を減量する必要がある。低出生体重児及び新生児は各臓器機能が未発達であり、血中の消失時間が長く、また、本剤の呼吸器系への作用に対しても脆弱である。,
- 9.7.4 6ヵ月未満の小児では、呼吸数、酸素飽和度を慎重に観察すること。特に気道閉塞や低換気を発現しやすい。
- 9.7.5 小児等において、激越、不随意運動(強直性/間代性痙攣、筋振戦を含む)、運動亢進、敵意、激しい怒り、攻撃性、発作性興奮、暴行等の逆説反応が起こりやすいとの報告がある。
10. 相互作用
10.1 併用禁忌(併用しないこと)
10.2 併用注意(併用に注意すること)
| 薬剤名等 | 臨床症状・措置方法 | 機序・危険因子 |
|---|---|---|
|
鎮静・麻酔作用が増強されたり、呼吸数、収縮期血圧、拡張期血圧、平均動脈圧及び心拍出量が低下するおそれがある。 |
これらの薬剤との併用により、相加的に中枢神経抑制作用(鎮静・麻酔作用、呼吸及び循環動態への作用)を増強する可能性がある。 |
|
|
本剤又はこれらの薬剤の作用が増強されるおそれがある。 |
これらの薬剤との併用により、代謝が競合的に阻害され、本剤及びこれらの薬剤の血中濃度が上昇することが考えられている。 |
|
|
中枢神経抑制作用が増強されるおそれがある。 |
これらの薬剤によるCYP3A4に対する競合的阻害作用により、本剤の血中濃度が上昇したとの報告がある。 |
|
|
骨髄抑制等の副作用が増強するおそれがある。 |
本剤がチトクロームP450を阻害し、これらの薬剤の代謝を阻害し血中濃度が上昇することが考えられている。 |
|
|
プロポフォール |
麻酔・鎮静作用が増強されたり、収縮期血圧、拡張期血圧、平均動脈圧及び心拍出量が低下することがある。 |
相互に作用(麻酔・鎮静作用、血圧低下作用)を増強させる。また、CYP3A4に対する競合的阻害作用により、本剤の血中濃度が上昇したとの報告がある。 |
|
本剤の作用を減弱させることがある。 |
CYP3A4が誘導され、本剤の代謝が促進される。 |
11. 副作用
11.1 重大な副作用
- 11.1.1 *呼吸抑制(5%以上)、無呼吸、舌根沈下(いずれも頻度不明)
- 11.1.2 心停止(頻度不明)
- 11.1.3 心室頻拍、心室性頻脈(いずれも頻度不明)
- 11.1.4 ショック、アナフィラキシー(いずれも頻度不明)
-
11.1.5 悪性症候群(Syndrome malin)(頻度不明)
無動緘黙、強度の筋強剛、嚥下困難、頻脈、血圧の変動、発汗等が発現し、それに引き続き発熱がみられる場合は、投与を中止し、体冷却、水分補給等の全身管理とともにダントロレンナトリウムの投与等適切な処置を行うこと。本症発症時には、白血球の増加や血清CKの上昇がみられることが多く、また、ミオグロビン尿を伴う腎機能の低下がみられることがある。
なお、高熱が持続し、意識障害、呼吸困難、循環虚脱、脱水症状、急性腎障害へと移行することがある。 -
11.1.6 依存性(頻度不明)
連用により薬物依存を生じることがあるので、観察を十分に行い、用量及び使用期間に注意し慎重に投与すること。連用中における投与量の急激な減少ないし中止により、痙攣発作、せん妄、振戦、不眠、不安、幻覚、妄想、不随意運動等の離脱症状があらわれることがあるので、投与を中止する場合には、徐々に減量するなど慎重に行うこと。
11.2 その他の副作用
|
5%以上 |
1~5%未満 |
頻度不明 |
|
|---|---|---|---|
|
呼吸器 |
- |
- |
しゃっくり、咳、喀痰 |
|
*循環器 |
血圧低下 |
- |
不整脈、血圧上昇、頻脈、徐脈、血圧変動、心房細動 |
|
精神神経系 |
- |
- |
覚醒遅延、悪夢、めまい、頭痛、不穏、興奮、ふるえ、視覚異常、せん妄、不随意運動、傾眠 |
|
*消化器 |
- |
便秘 |
悪心、嘔吐、嘔気 |
|
肝臓 |
- |
AST上昇 |
ALT上昇、γ-GTP上昇、総ビリルビン上昇、ALT低下、LDH上昇、Al-P上昇 |
|
過敏症 |
- |
発疹 |
紅斑、蕁麻疹、そう痒感 |
|
*その他 |
- |
発熱、CRP上昇 |
体動、発汗、顔面浮腫、体温低下、白血球数上昇、CK上昇 |
13. 過量投与
14. 適用上の注意
16. 薬物動態
16.1 血中濃度
-
16.1.1 *小児患者(けいれん性てんかん重積状態)
けいれん性てんかん重積状態の小児患者にミダゾラムを静脈内投与(累積投与量:0.145~0.600mg/kg)したとき、投与30分後の血漿中ミダゾラム濃度は21.6~987.5ng/mLであった(0.5~13.3歳の14例での最小値~最大値)。また、ミダゾラムを静脈内投与(累積投与量:0.150~0.300mg/kg)したときの血漿中ミダゾラムの消失半減期(t1/2)は0.999時間(1.1~13.3歳の7例での平均値)であった。静脈内投与後に持続静脈内投与(投与量:0.100~0.400mg/kg/時)した場合、ミダゾラムの血漿中濃度は投与開始後12時間までに定常状態に達し、全身クリアランス(CL)は7.05~33.5mL/分/kg(0.8~13.7歳の7例での最小値~最大値)であった1) 。
-
16.1.2 小児及び新生児患者
1歳以上の小児患者におけるt1/2は健康成人と同様又は低値(0.78~2.4 vs 1.7~2.6時間)、CLは健康成人と同様又は高値(4.69~19.74 vs 6.4~11.0mL/分/kg)であり、新生児救命救急患者ではt1/2が顕著に延長(6.52~12時間)、CLが減少(1.17~1.84mL/分/kg)したが、この原因が代謝能又は器官機能の未成熟、疾患又は衰弱のいずれにあるのかは特定されていない2) ,3) (外国人データ)。,
-
16.1.3 健康被験者
健康成人男子(3~6例)にミダゾラム0.1~0.3mg/kgを単回静脈内投与したときのt1/2は1.82~2.68時間であった4) 。健康成人にミダゾラム0.1~0.3mg/kgを単回静脈内投与したときのt1/2は2.29~3.28時間、CLは4.4~6.28mL/分/kgであった5) ,6) ,7) (外国人データ)。
16.3 分布
16.4 代謝
ヒト肝小胞体を用いたin vitro代謝試験において、1’-ヒドロキシ体及び4-ヒドロキシ体の2つの代謝物が生成され、いずれの水酸化反応にもCYP3A4が関与することが確認された12) (外国人データ)。,
16.5 排泄
健康成人男子(3~6例)にミダゾラム0.1~0.3mg/kgを単回静脈内投与したとき、投与後24時間までに投与量の66.1~87.8%が1’-ヒドロキシメチル体として尿中に排出された4) 。
16.6 特定の背景を有する患者
-
16.6.1 心機能障害患者
成人のうっ血性心不全患者(5例)にミダゾラム3.75mgを単回静脈内投与したとき、t1/2は健常成人(6例)と比べて延長(4.5 vs 2.9時間)し、CLは減少(376 vs 551mL/分)した13) (外国人データ)。
-
16.6.2 腎機能障害患者
成人の慢性腎不全患者(7例)にミダゾラム0.2mg/kgを単回静脈内投与したとき、腎機能が正常な対照患者(7例)に対してCL(15.8 vs 10.1mL/分/kg)及びVd(1.02 vs 0.70L/kg)は増加したが、t1/2(2.84 vs 2.75時間)に変化は認められなかった14) 。
-
16.6.3 肝機能障害患者
成人の肝硬変患者(9例)にミダゾラム0.2mg/kgを単回静脈内投与したとき、肝機能が正常な対照患者(7例)に対して、CL(6.4 vs 10.1mL/分/kg)及びVd(0.53 vs 0.70L/kg)は減少したが、t1/2(2.83 vs 2.75時間)に変化は認められなかった14) 。
成人のアルコール性肝硬変患者(5例)にミダゾラム0.075mg/kgを単回静脈内投与したとき、肝機能が正常な対照患者(8例)に対して、t1/2は延長(3.9 vs 1.6時間)、CLは減少(5.4 vs 10.4mL/分/kg)し、Vdは増加(106.19 vs 80.7L)した15) (外国人データ)。 -
16.6.4 高齢者
健康成人(男女各10例)及び健康高齢者(男性9例、女性11例)にミダゾラム2.5~5mgを単回静脈内投与したとき、高齢者のt1/2は非高齢者に比べて延長(男性:5.6 vs 2.1時間、女性:4.0 vs 2.6時間)し、分布容積(Vd)に差はなく(男性:1.6 vs 1.3L/kg、女性:2.1 vs 2.0L/kg)、CLは減少(男性:4.4 vs 7.8mL/分/kg、女性:7.5 vs 9.4mL/分/kg)した8) (外国人データ)。
17. 臨床成績
17.1 有効性及び安全性に関する試験
-
17.1.1 *小児を対象とした国内臨床試験
ジアゼパム静脈内投与が無効であったけいれん性てんかん重積状態の小児患者(0.5~13.7歳)に、本剤0.15mg/kg(より慎重な投与が必要な場合には0.1mg/kg)を静脈内投与し、発作が軽減又は無効と判定された場合は発作が消失するまで又は累積0.6mg/kgに達するまで、1回あたり0.1~0.3mg/kgを追加静脈内投与したとき、34例中30例(88.2%)で発作が消失した。静脈内投与に引き続き、本剤0.1~0.4mg/kg/時(0.1mg/kg/時で投与開始し、24時間以内に発作が再発した又は発作が消失しない場合は0.05~0.1mg/kg/時ずつ最大0.4mg/kg/時まで増量)を最終投与量での投与開始時点から24時間まで持続静脈内投与したとき、最終的に発作消失で持続静脈内投与を終了した症例は、12例中8例(66.7%)であった。
副作用発現頻度は8.6%(3/35例)であり、副作用は、発熱、呼吸抑制、発疹及びアスパラギン酸アミノトランスフェラーゼ増加が各1例(2.9%)であった16) 。 -
17.1.2 *成人を対象とした国内臨床試験
15歳以上の患者を対象とした臨床試験において、けいれん性てんかん重積状態の患者(18.0~89.0歳)に、本剤0.15mg/kg(より慎重な投与が必要な場合には0.1mg/kg)を静脈内投与し、発作が消失せずと判定された場合は発作が消失するまで又は累積0.6mg/kgに達するまで、1回あたり0.1~0.3mg/kgを追加静脈内投与したとき、21例全例で発作が消失した。静脈内投与に引き続き、本剤0.1~0.4mg/kg/時(0.1mg/kg/時で投与開始し、24時間以内に発作が再発した又は発作が消失しない場合は0.05~0.1mg/kg/時ずつ最大0.4mg/kg/時まで増量)を最終投与量での投与開始時点から24時間まで持続静脈内投与したとき、最終的に発作消失で持続静脈内投与を終了した症例は、3例中1例(33.3%)であった。
副作用発現頻度は28.6%(6/21例)であり、主な副作用は、血圧低下4例(19.0%)、便秘、呼吸抑制が各2例(9.5%)であった17) 。
19. 有効成分に関する理化学的知見
一般的名称
ミダゾラム(Midazolam)
化学名
8-Chloro-6-(2-fluorophenyl)-1-methyl-4H-imidazo[1,5-a][1,4]benzodiazepine
分子式
C18H13ClFN3
分子量
325.77
性状
白色~帯微黄白色の結晶性の粉末である。
化学構造式
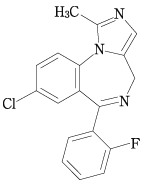
21. 承認条件
*医薬品リスク管理計画を策定の上、適切に実施すること。
22. 包装
10mL[10バイアル(褐色)]
23. 主要文献
1) *社内資料:ミダゾラムの国内第III相臨床試験-けいれん性てんかん重積状態の小児患者を対象とした非盲検試験-における薬物動態解析
2) Blumer, JL. : Clin Pharmacokinet. 1998;35:37-47
3) Burtin, P. et al. : Clin Pharmacol Ther. 1994;56:615-625
4) 花岡一雄他:臨床薬理. 1983;14:573-591
5) Heizmann, P. et al. : Br J Clin Pharmacol. 1983;16:43S-49S
6) Clausen, TG. et al. : Br J Clin Pharmacol. 1988;25:457-463
7) Pecking, M. et al. : Br J Clin Pharmacol. 2002;54:357-362
8) Greenblatt, DJ. et al. : Anesthesiology. 1984;61:27-35
9) Wilson, CM. et al. : Anaesthesia. 1987;42:1057-1062
10) Wilson, CM. et al. : Ir J Med Sci. 1986;155:322
11) Koitabashi, T. et al. : J Anesth. 1997;11:242-243
12) Kronbach, T. et al. : Mol Pharmacol. 1989;36:89-96
13) Patel, IH. et al. : Br J Clin Pharmacol. 1990;29:565-569
14) 澄川耕二他:臨床麻酔. 1991;15:167-170
15) MacGilchrist, AJ. et al. : Gut. 1986;27:190-195
16) Hamano, SI. et al. : J Neurol Sci. 2019; 396: 150-158
17) *社内資料:ミダゾラムの国内第III相臨床試験-15歳以上のけいれん性てんかん重積状態の患者を対象とした非盲検試験-(2021年9月27日承認、CTD2.7.6.3)
18) Yu, OF. et al. : Brain Res. 1988;451:376-380
19) Skerritt, JH. et al. : Eur J Pharmacol. 1983;89:193-198
20) Shih, T. et al. : J Biomed Sci. 1999;6:86-96
21) Fauvelle, F. et al. : J Proteome Res. 2012;11:3782-3795
22) Kofke, WA. et al. : Anesth Analg. 1993;77:330-337
23) Pieri, L. et al. : Arzneimittelforschung. 1981;31:2180-2201
24. 文献請求先及び問い合わせ先
アルフレッサ ファーマ株式会社 製品情報部
〒540-8575 大阪市中央区石町二丁目2番9号
TEL 06-6941-0306 FAX 06-6943-8212
26. 製造販売業者等
26.1 製造販売元
アルフレッサ ファーマ株式会社
大阪市中央区石町二丁目2番9号