免疫グロブリンカッパ/ラムダ鎖キット
N-ラテックス FLC カッパ型/ラムダ型
作成・改訂年月
**2013年5月改訂(第3版)*2013年4月改訂(第2版)
薬効分類名
体外診断用医薬品
一般的注意事項
この添付文書をよく読んでから使用ください。
承認・届出等
販売名
N-ラテックス FLC カッパ型/ラムダ型
商品コード(JAN)(品番)
4987177106635
4987177106642
識別記号
OPJA03/OPJB03
添付文書管理コード
224ABAMX00089000_A_01
製造販売認証番号
224ABAMX00089000
製造販売認証年月
平成24年7月
一般的名称
一般的名称
30236000
免疫グロブリンカッパ/ラムダ鎖キット
全般的な注意
・本品は体外診断用医薬品ですので、それ以外の目的に使用しないでください。
・本品の測定結果は、患者の治療歴、臨床症状その他関連する他の検査結果等を考慮して総合的に判断ください。
・添付文書に記載されている以外の使用方法については保証しません。
・使用する機器の添付文書及び取扱説明書をよく読んでから使用ください。
・試薬には、ヒト由来成分が含まれており、感染の危険がありますので、感染性のあるものとして取扱ってください。
形状・構造等(キットの構成)
1.
N-ラテックス FLC カッパ型(OPJA03) 1.7mL×3バイアル
N Latex FLC kappa
抗ヒト免疫グロブリン遊離L鎖κ型マウスモノクローナル抗体吸着ポリスチレン粒子
ヒトアルブミン
アジ化ナトリウム(<1g/L)
2.
N-ラテックス FLC ラムダ型(OPJB03) 2.1mL×3バイアル
N Latex FLC lambda
抗ヒト免疫グロブリン遊離L鎖λ型マウスモノクローナル抗体吸着ポリスチレン粒子
ヒトアルブミン
アジ化ナトリウム(<1g/L)
使用目的
血清又は血漿中の免疫グロブリン遊離L鎖κ型又はλ型の測定
測定原理
ネフェロメトリー法
検体中の遊離L鎖は、試薬中の抗ヒト免疫グロブリン遊離L鎖κ型又はλ型抗体吸着ポリスチレン粒子と凝集します。この凝集塊に検体に照射された光が散乱し、散乱強度は検体中の免疫グロブリン遊離L鎖κ型又はλ型の濃度に比例し、既知濃度の標準液から得られた検量線より免疫グロブリン遊離L鎖κ型又はλ型の濃度が求められます。
操作上の注意
1.
測定試料の性質、採取法
・血清又は血漿(ヘパリン、EDTA)を使用ください。
**・検体はできるだけ新鮮なものか又は凍結保存されたものを使用ください。検体は2〜8℃で5日間安定です。採血後24時間以内に凍結し、凍結融解を繰り返さなければ、−20℃以下で6ヶ月間安定です。
・血清検体は完全に凝固させてから遠心分離し、遠心分離後に粒子やフィブリンが残らないようにしてください。
・乳び検体や凍結融解後の濁った検体は、遠心処理(15,000×g/10分間)を行ってから使用ください。
2.
妨害物質・妨害薬剤
リウマトイド因子は2000IU/mLまで、トリグリセライドは5g/Lまで、抱合型ビリルビンは1025μmol/Lまで、非抱合型ビリルビンは618μmol/Lまで、遊離ヘモグロビンは5g/Lまで、総タンパクは140g/Lまで、血清検体中に存在しても本法への影響は認められませんでした。一般的に使用される薬剤の本法への影響は、認められておりません。
3.
その他
本品は、BNシステム[BNプロスペック、ベーリング ネフェロメータ II(以下、BN II)]の専用試薬です。
用法・用量
BNシステムを用いて測定する場合は、以下のように操作します。但し、機器の操作については取扱説明書を参照ください。
1.
試薬の調製法
試薬はすべて液状のため調製する必要がありませんのでそのまま使用ください。使用前に静かに混和ください。
2.
試薬の保存条件と安定性
・試薬は、すべて未開封で2〜8℃に保存した場合ラベルに記載されている使用期限まで安定です。
・使用後直ちに2〜8℃で密封保存し、微生物などによる汚染がない場合は、4週間使用可能です。
・試薬は凍結しないでください。
・BNシステムで使用する場合、1日約8時間の搭載で5日間安定です。機器搭載後の安定性は、機器の種類や施設の環境に依存します。詳細は、BNシステムの取扱説明書を参照ください。
3.
必要な器具・器材・試料等
・BNシステム(BNプロスペック、BN II)
機器の消耗品は、BNシステムの取扱説明書を参照ください。
・本品以外に必要な試薬(別売)
・N-FLC 補助試薬(OPJC03)
・N-FLC 標準血清 SL(OPJD03)
・N-FLC コントロール SL1(OPJE03)
・N-FLC コントロール SL2(OPJF03)
・SCS クリーナー(OQUB195)(N-ラテックス FLCラムダ型に使用)
・N-希釈液(1500mL用:JP00083、5000mL用:JP00084)
4.
操作法
(1)
N-ラテックス FLC カッパ型又はN-ラテックス FLC ラムダ型(以下、N-ラテックス試薬)及び検体を専用のBNシステムにセットすると、検体がN-希釈液(別売)により免疫グロブリン遊離L鎖κ型の測定では100倍に、免疫グロブリン遊離L鎖λ型の測定では20倍に希釈されます。
(2)
N-希釈液(55μL)、N-FLC 補助試薬(15μL)及び希釈された検体(7〜8μL)が反応キュベットに分注混和されます。
(3)
続いて、N-希釈液(90〜95μL)及びN-ラテックス試薬(45〜55μL)が反応キュベットに分注混和され、2分間反応が行われた後、抗原過剰を確認するために反応液の散乱強度がネフェロメトリー(波長:840nm)で測定されます。
(4)
さらに、N-希釈液(約5μL)及び希釈された検体(55〜75μL)が分注混和され、10分間反応が行われ、反応液の散乱強度がネフェロメトリー(波長:840nm)で測定されます。
(5)
上記と同様に操作して測定された標準液の散乱強度から得られた検量線より、検体中の免疫グロブリン遊離L鎖κ型又はλ型濃度(mg/L)が求められます。
・機器の操作法はBNシステムの取扱説明書を参照ください。
・2〜8℃に保存されていた試薬及び検体をそのまま機器に装填することが可能です。
・試薬及び検体を機器にセットし、あらかじめBNシステムに搭載されているアッセイプロトコールに従って測定を開始します。続くすべての操作ステップは機器により自動的に行われます。
・N-FLC 標準血清 SLの希釈系列がN-希釈液を使用してBNシステムにより自動的に行われ、マルチポイントの検量線が作成されます。希釈されたN-FLC 標準血清 SLは、4時間以内に使用されます。検量線は6週間有効です。検量線は、N-FLC コントロール SL1及びSL2の測定値がそれぞれ範囲内である限りは使用可能です。試薬のロット変更時には、必ず新しい検量線を作成ください。実際の測定範囲はN-FLC 標準血清 SLの各ロットのタンパク濃度に依存します。詳細はBNシステムの取扱説明書を参照ください。
・検体は、N-希釈液で機器により自動的に、N-ラテックス FLC カッパ型では100倍に、N-ラテックス FLC ラムダ型では20倍に希釈されます。希釈された検体は、4時間以内に測定ください。測定範囲外の検体は、高希釈倍率又は低希釈倍率で再測定が可能です。詳細はBNシステムの取扱説明書を参照ください。
・結果の算出はBNシステムにより、mg/L又は使用者が選択した単位で自動的に求められます。さらに、κ/λ比の計算も行われます。
5.
精度管理
検量線の作成後や試薬開封時及び検体の測定毎にN-FLC コントロール SL1及びSL2を必ず測定ください。コントロールは、患者検体同様に測定、評価ください。表示値及び範囲は、コントロールの濃度表に記載されています。精度管理の頻度は、行政当局の規制や認可条件に従ってください。
コントロールの結果が範囲外であった場合は、再測定ください。再測定後も範囲外の場合は、新しい検量線を作成ください。原因が確認され修正されるまで測定値を報告しないでください。
測定結果の判定法
1.
基準範囲
369名の健常者よりノンパラメトリック法(95パーセンタイル)により基準範囲を求めました
1。次の基準範囲は健常成人の血清及び血漿検体に適用されます。

κ/λ比は、中央値:0.86、最小値:0.31、最大値:1.56でした。
基準範囲は参考とした集団に影響されます。各施設で基準範囲を設定ください。
2.
測定結果の判定法
・検体の濁り及び浮遊物は本法に影響しますので、浮遊物を含む検体は測定前に遠心分離ください。遠心分離(15,000×g、約10分間)でも取り除けない乳び検体や濁った検体は使用しないでください。
・患者検体中に異好抗体が存在すると、免疫反応に正又は負の誤差を与えることがあります2。このため、本法は検体中の異好抗体の影響を最小限にする工夫がされていますが、すべての患者検体からこの影響を除去できるわけではありませんので、注意して診断ください。
・過度に高濃度の単クローン性免疫グロブリンは抗遊離L鎖抗体と遊離L鎖の反応を抑制することがあります。測定結果が、以前に測定した結果や他の試験結果(血清免疫電気泳動法、免疫固定法、血球百分率など)また臨床症状と矛盾する場合は、高倍率で希釈した検体を再測定することをお薦めします。
・マトリックス効果のため、検査室間試験検体及び対照検体の測定値が、他の方法で得られた結果と異なる場合があります。このため、測定法ごとに目標値を設定して判定する必要があります。
臨床的意義
免疫グロブリン遊離L鎖の測定は、多発性骨髄腫、ワルデンシュトレーム型マクログロブリン血症、ALアミロイドーシス、L鎖沈着病、リンパ性腫瘍の診断とモニタリングの補助として有用です。
正常な免疫反応では、2つの同一なH鎖(α、γ、μ、δ、ε)及び2つの同一なL鎖(κ、λ)から完全型免疫グロブリン分子が構築されます。免疫グロブリンの種類(IgA、IgG、IgM、IgD、IgE)は、L鎖κ型又はL鎖λ型のいずれかと結合するH鎖によって決まります。1つの形質細胞は1種類のH鎖と1種類のL鎖を生成し、これらは集められて血漿へ分泌されます。形質細胞クローンで生成されるH鎖の量よりも、L鎖は常に若干多く生成され、未結合型又は遊離L鎖(FLC)として血流中へ放出されます。そのため、健常者では、ほとんどのL鎖は完全型免疫グロブリンとして結合状態で存在し、循環している遊離L鎖は少量です。遊離L鎖κ型が約22.5kDの単量体で血中を循環するのに対し、遊離L鎖λ型は約45kDの2量体で循環します。遊離L鎖κ型及びλ型のいずれも腎臓で排泄されますが、分子量の違いから糸球体ろ過量は遊離L鎖κ型の方が遊離L鎖λ型よりも高いため、血漿中L鎖総κ/λ比が約2であるのに対し、遊離L鎖の平均κ/λ比は0.6です。
単クローン性ガンマグロブリン血症では、特定1種の免疫グロブリンの生成が大幅に増加し、合わせて特定の遊離L鎖の過剰生成が伴うため、遊離L鎖κ型又はλ型どちらかの血清レベルが上昇し、遊離L鎖κ/λ比が基準値と比較して上昇又は減少します。また、遊離L鎖の測定は、多発性骨髄腫のスクリーニング及びモニタリングとして近年国際的に推奨されています3-7。
性能
1.
性能
(1)
感度
免疫グロブリン遊離L鎖κ型濃度約3.4mg/Lの標準液とブランク液を測定したときの散乱強度の差は、70ビット*以上です。
免疫グロブリン遊離L鎖λ型濃度約1.8mg/Lの標準液とブランク液を測定したときの散乱強度の差は、70ビット*以上です。
*ネフェロメータより出力される散乱強度を表す単位
(2)
正確性
低・中・高3濃度の濃度既知管理用検体を測定するとき、その測定値は表示値の±20%内です。
(3)
同時再現性
異なる3濃度の濃度既知管理用検体を各々3回同時に測定するとき、その変動係数(CV)は10%以下です。
(4)
測定範囲
N-ラテックス FLC カッパ型:3.4〜110mg/L(100倍希釈時)
N-ラテックス FLC ラムダ型:1.9〜60mg/L(20倍希釈時)
これは機器により自動的に希釈された検体の測定範囲です。詳細はBNシステムの取扱説明書を参照ください。
2.
その他のデータ
(1)
感度
本法の分析感度は、検量線の下限値より設定されるので、N-FLC 標準血清 SLの蛋白濃度に依存します。
(2)
特異性
N-ラテックス FLC カッパ型及びN-ラテックス FLC ラムダ型は、それぞれ免疫グロブリン遊離L鎖κ型及びλ型に特異性があります。
(3)
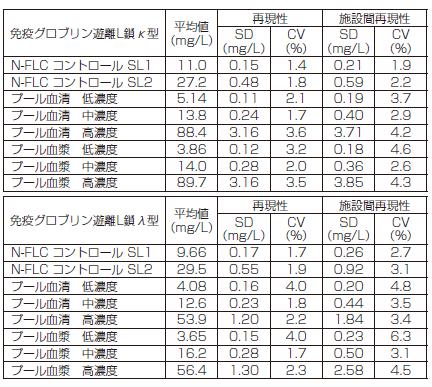
精密性
本品を用いて、次の変動係数(CV)(n=40)を得ました
1。結果は、CLSI EP5-A2に従って評価しました
8。
(4)
相関性
本品(y)と他社製品(ネフェロメトリー法)(x)の相関性を検証した結果は以下のとおりです。
免疫グロブリン遊離L鎖κ型:log(y)=0.9 log(x)+0.3、r=1.0、n=211
免疫グロブリン遊離L鎖λ型:log(y)=0.9 log(x)+0.2、r=0.9、n=212
単クローン性ガンマグロブリン血症患者から得られた血清152検体を免疫固定法、本品、及び市販の免疫ネフェロメトリー法(対照品)を用いて測定しました。免疫固定法で測定した結果、152検体中115検体がL鎖陽性となりました(κ型陽性:56検体、λ型陽性:55検体、κ型・λ型陽性:4検体)。
本品の免疫グロブリン遊離L鎖κ型、λ型、及びκ/λ比の感度は、それぞれ100%(60/60)、98.3%(58/59)、91.3%(105/115)でした。対照品の免疫グロブリン遊離L鎖κ型、λ型、及びκ/λ比の感度は、それぞれ98.3%(59/60)、94.9%(56/59)、89.6%(103/115)でした。
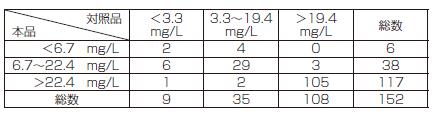
対照品との相関性
免疫グロブリン遊離L鎖κ型:一致率 137/152=90.1%
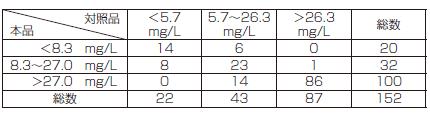
免疫グロブリン遊離L鎖λ型:一致率 124/152=81.5%
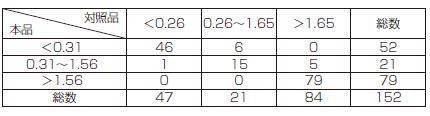
免疫グロブリン遊離L鎖κ/λ比:一致率 140/152=92.2%
3.
較正用の基準物質(標準物質)
社内標準品
使用上又は取扱い上の注意
取扱い上(危険防止)の注意
・試料(検体)はHIV、HBV、HCV等の感染の恐れがあるものとして取り扱ってください。検査実施にあたっては感染の危険を避けるため使い捨て手袋を着用し、また口によるピペッティングを行わないでください。
・試薬にはヒト由来成分が含まれています。原料は、EU又は米国で承認された検出法により、HIV1及び2、HBV、HCVに対し陰性を示したものを用いていますが、どのような方法も完全とは言えませんので、使用時には感染の危険性があるものとして取扱い上の注意を守り、皮膚に触れたり飲み込んだりしないよう注意ください。
・試薬はアジ化ナトリウム(<1g/L)を含んでいますので、誤って飲み込んだり皮膚や粘膜に触れたりしないように注意ください。もし、皮膚に付着した場合は、多量の水で洗い流すなどの応急処置を行い、必要があれば医師の手当て等を受けてください。
使用上の注意
・本品は凍結を避け、貯蔵方法に従い保存ください。
・使用期限を過ぎた試薬は使用しないでください。
・同一ロットであっても、試薬の注ぎ足しはしないでください。
・本品は、BNシステムで最適な性能及び仕様に沿った使用ができることを確認しています。使用者が行った変更は本品の性能や測定結果に影響することがあるので保証できません。添付文書やアプリケーションシートに記載されている以外の操作方法や試薬の使用の変更の確認は、使用者の責任において行ってください。
廃棄上の注意
・試料(検体)中にはHIV、HBV、HCV等の感染性のものが存在する場合がありますので、廃液、使用済み器具などは適当な消毒処理あるいは滅菌処理を行ってください。
・保存剤としてアジ化ナトリウム(<0.1%)を含んでいます。アジ化ナトリウムは銅や鉛等の重金属と反応して爆発性のアジ化塩を形成することがありますので、廃棄の際はゆっくりと大量の水で洗い流してください。
・残った試薬や検体を廃棄する場合には、医療廃棄物に関する規定に従って、医療廃棄物又は産業廃棄物等区別して処理ください。廃棄の際は各法令に従いゆっくりと大量の水で洗い流してください。
・試薬類や廃液などが飛散した場合には、拭き取りと消毒を行ってください。
貯蔵方法・有効期間
貯蔵方法:2〜8℃
有効期間:N-ラテックス FLC カッパ型(OPJA03)12ヶ月(使用期限は外箱に表示)
N-ラテックス FLC ラムダ型(OPJB03)12ヶ月(使用期限は外箱に表示)
包装単位
N-ラテックス FLC カッパ型(OPJA03) 1.7mL×3バイアル
N-ラテックス FLC ラムダ型(OPJB03) 2.1mL×3バイアル
主要文献
1.
te Velthuis H, Knop I, Stam P et al. N Latex FLC - new monoclonal high-performance assays for the determination of free light chain kappa and lambda. Clin Chem Lab 2011; 49(8): 1323-32.
2.
Kricka LJ. Human anti-animal antibody interference in immunological assays. Clin Chem 1999;45:942-956.
3.
Pratt G. The evolving use of serum free light chain assays in haematology. Br J Haematol 2008; 141: 413-22.
4.
Katzmann JA. Screening panels for monoclonal gammopathies: time to change. Clin Biochem Rev 2009; 30: 105-11.
5.
Dispenzieri A, Kyle R, Merlini G et al. International Myeloma Working Group guideline for serum-free light chain analysis in multiple myeloma and related disorders. Leukemia 2009; 23: 215-24.
6.
Snozek CLH, Katzmann JA, Kyle RA et al. Prognostic value of the serum free light chain ratio in newly diagnosed myeloma: proposed incorporation into the international staging system. Leukemia 2008; 22: 1933-7.
7.
Durie BGM, Harousseau JL, Miguel JS et al. International uniform response criteria for multiple myeloma. Leukemia 2006; 20: 1467-73.
8.
Clinical and Laboratory Standards Institute (CLSI). Evaluation of precision performance of quantitative measurement methods; Approved Guideline-Second Edition. CLSI document EP5-A2 (ISBN 1-56238-542-9). CLSI, 940 West Valley Road, Suite 1400, Wayne, PA 19087-1898 USA, 2004.
製造販売元
シーメンスヘルスケア・ダイアグノスティクス株式会社
第二種医薬品製造販売業
*東京都品川区大崎1-11-1
ゲートシティ大崎ウエストタワー
*問い合わせ先
シーメンスヘルスケア・ダイアグノスティクス株式会社
カスタマーケアセンター





