薬効分類名
体外診断用医薬品
一般的注意事項
ご使用の際は、添付文書をよくお読みください。
承認・届出等
販売名
キャピリアFlu A+B
商品コード(JAN)(品番)
4987241-201747
商品コード(JAN)(品番)
4987241-201754
添付文書管理コード
21600AMZ00026000_A_01
製造販売承認番号
21600AMZ00026000
承認・認証年月等
平成16年1月
一般的名称
一般的名称
30813000
インフルエンザウイルスキット
警告(記載なし)
|
重要な基本的注意1.
インフルエンザウイルス感染の診断は、本製品による検査結果のみで行わず、他の検査結果及び臨床症状を考慮して総合的に判断して下さい。
2.
咽頭ぬぐい液を検体とした場合、鼻腔ぬぐい液、鼻腔吸引液に比べ検出感度が低い傾向にあるので、検体の採取法にご留意下さい。
|
全般的な注意
1.
テストプレートは、開封後直ちに使用して下さい。
2.
吸湿すると品質が劣化し、正確な結果が得られません。
3.
用法・用量および注意事項に従って操作して下さい。
4.
本試薬は体外診断用のみに使用し、それ以外の目的では使用しないで下さい。
5.
本添付文書に記載された使用方法に従って使用して下さい。記載された操作方法及び使用目的以外での使用については結果の信頼性を保証いたしかねます。
6.
検体抽出液にはアジ化ナトリウム等が含まれていますので、誤って目や口に入ったり皮膚に付着した場合には水で十分に洗い流す等の応急処理を行い、必要があれば医師の手当て等を受けて下さい。
形状・構造等(キットの構成)
1.
テストプレート金コロイド標識抗インフルエンザAおよびBウイルスモノクローナル抗体(マウス)
抗インフルエンザAウイルスモノクローナル抗体(マウス)
抗インフルエンザBウイルスモノクローナル抗体(マウス)
抗マウス免疫グロブリンポリクローナル抗体(ウサギ)
2.
検体抽出液緩衝剤、界面活性剤、アジ化ナトリウム
使用目的
鼻腔吸引液、鼻腔ぬぐい液、および咽頭ぬぐい液中のインフルエンザAウイルス抗原およびインフルエンザBウイルス抗原の検出
測定原理
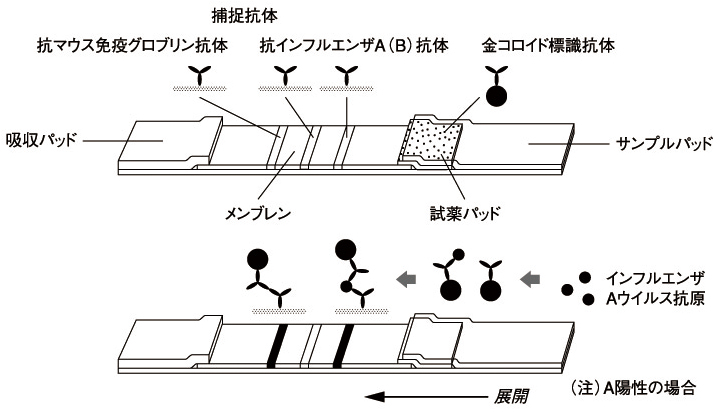
本品は、試料滴下部、金コロイド標識抗インフルエンザAおよびインフルエンザBウイルスモノクローナル抗体(マウス)(以下、金コロイド標識抗体と記す)を含む試薬部、抗インフルエンザAウイルスモノクローナル抗体(マウス)(以下、抗インフルエンザA抗体と記す)、抗インフルエンザBウイルスモノクローナル抗体(マウス)(以下、抗インフルエンザB抗体と記す)および抗マウス免疫グロブリンポリクローナル抗体(ウサギ)(以下、抗マウス免疫グロブリン抗体と記す)を固定化した展開部から構成される短冊状の担体を内蔵したテストプレートです。
テストプレート各部の名称
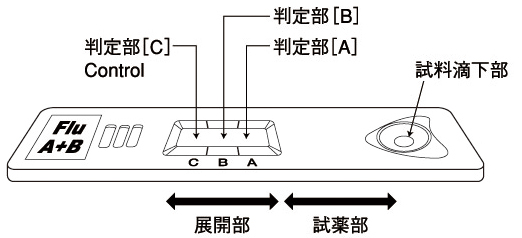
テストプレートの試料滴下部に試料を滴下すると金コロイド標識抗体が溶解し、試料中のインフルエンザウイルス抗原と免疫複合体を形成します。この免疫複合体は展開部を毛細管現象により移動し、展開部に固定化された抗インフルエンザA抗体または/および抗インフルエンザB抗体に補足され、判定部[A]または/および判定部[B]に金コロイドによる赤紫色のラインを形成します。本キットはこの赤紫色のラインを目視で確認し、試料中のインフルエンザウイルス抗原の存在の有無を判定します。
一方、試料中のインフルエンザウイルス抗原の存在の有無に関わらず、余剰の金コロイド標識抗体は展開部をさらに移動し、展開部に固定化された抗マウス免疫グロブリン抗体に捕捉され、判定部[C]に金コロイドによる赤紫色のラインを形成します。これは金コロイド標識抗体が正常に移動したことを示します。
免疫クロマトグラフィー法によるインフルエンザウイルス抗原の検出
操作上の注意
1.
採取した検体は、できる限り早く次頁の試料の調製方法に従い試料調製を行って下さい。
2.
全ての検体は感染の危険があるものとして、十分に注意をして取り扱って下さい。
検体の採取方法
| 1.鼻腔吸引液の採取方法 吸引トラップの片方のチューブを吸引ポンプに、もう一方のチューブを外鼻孔から鼻腔にしっかり挿入します。吸引ポンプを作動させて鼻腔液を吸引トラップに採取します。 | 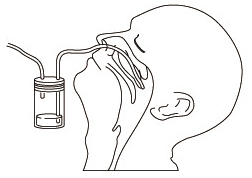 |
| 2.鼻腔ぬぐい液の採取方法 滅菌綿棒を鼻腔にしっかり挿入し、鼻甲介を数回こするようにして粘膜表皮を採取します。 | 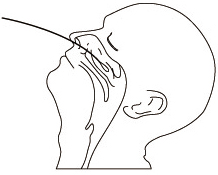 |
| 3.咽頭ぬぐい液の採取方法 滅菌綿棒を口腔から咽頭にしっかり挿入し、咽頭後壁、口蓋扁桃の発赤部位を中心に数回こするようにして粘膜表皮を採取します。 採取時は、だ液に触れないように注意して下さい。 付属の綿棒は鼻腔用に適しています。咽頭用として市販の綿棒を使用する場合の綿球の材質はレーヨンとして下さい。 | 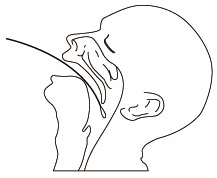 |
用法・用量(操作方法)
試料の調製方法
1.
鼻腔吸吸引液鼻腔吸引液0.5mLを輸送培地または生理食塩水2mLに懸濁します。
検体抽出液のふたを開け上記懸濁液を1mL(上部リングまで)加えたものを試料とします。
2.
咽頭・鼻腔ぬぐい液次の(1)または(2)の方法で試料調製を行います。
(1)
検体採取直後の滅菌綿棒をドロッパーチューブ中の検体抽出液に浸し攪拌します。ドロッパーチューブの外側から滅菌綿棒を指で数回つまんで検体抽出液を滅菌綿棒に充分浸透させた後、しごく様に滅菌綿棒を引き抜きます。絞り出した液体を試料とします。
フィルターに目詰まりするほどの強粘性の試料は、生理食塩水で2倍希釈して使用してください。
フィルターに目詰まりするほどの強粘性の試料は、生理食塩水で2倍希釈して使用してください。
(2)
試料の一部を他の試験(例えば培養試験など)に使用する場合は、予め試験管に輸送培地または生理食塩水1mLを入れておきます。検体採取直後の滅菌綿棒を試験管中の輸送培地または生理食塩水に浸し充分に攪拌します。この液を検体抽出液で2倍希釈したものを試料とします。
例:ドロッパーチューブ中の検体抽出液を下の目安線まで取り除いた後、輸送培地等で抽出した液を上の目安線まで加え充分に混和します。試験管中の残液は培養試験などに使用します。
例:ドロッパーチューブ中の検体抽出液を下の目安線まで取り除いた後、輸送培地等で抽出した液を上の目安線まで加え充分に混和します。試験管中の残液は培養試験などに使用します。
操作方法
1.
試薬調製方法試薬の調製は不要です。テストプレートは開封後直ちに使用して下さい。
2.
操作方法
(1)
ドロッパーチューブの上端に付属のフィルター付きノズルをしっかりと挿入し、転倒混和します。
(2)
ドロッパーチューブの中ほどをつまみテストプレートの試料滴下部に、試料3滴を滴下します。
(3)
15分後にテストプレートの判定部を観察し、判定します。
測定結果の判定法
1.
測定結果の判定方法操作方法に従って反応させ、判定部に現れる赤紫色のラインにより判定を行います。(判定部は、真上から観察)
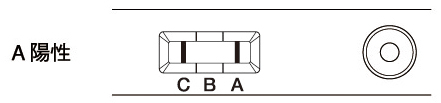 | 判定部[A]および[C]の両方に赤紫色のラインが認められた場合(2本のライン)をインフルエンザAウイルス抗原陽性と判定します。 判定部[A]にわずかでも赤紫色のラインが認められたら陽性と判定します。 |
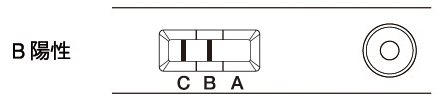 | 判定部[B]および[C]の両方に赤紫色のラインが認められた場合(2本のライン)をインフルエンザBウイルス抗原陽性と判定します。 判定部[B]にわずかでも赤紫色のラインが認められたら陽性と判定します。 |
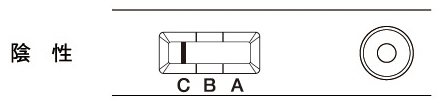 | 判定部[A]および[B]に赤紫色のラインが認められず、[C]にのみ赤紫色のラインが認められた場合(1本のライン)を陰性と判定します。 判定部[C]のラインは、薄くても目視で確認できれば正常にクロマト展開が行われていることを示しています。 |
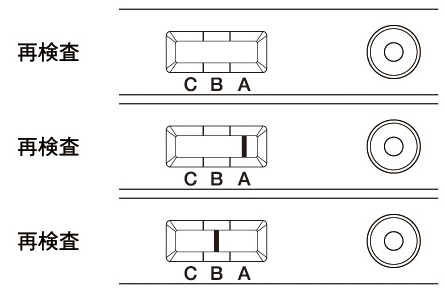 | 判定部[C]に赤紫色のラインが認められない場合は、測定操作上の問題、あるいは試薬の品質上の問題が考えられます。別のテストプレートで試験をやり直して下さい。また、抗原量が非常に多い場合には、判定部[A]または[B]に非常に濃いラインが認められ、判定部[C]に赤紫色のラインが認められないことがあります。このような場合は試料を検体抽出液で11倍希釈して再検査して下さい。 ラインは各判定部内であればその位置にかかわらず有効です。(各判定部の境界は判定窓の凸部で表しています。) |
2.
判定上の注意
(1)
金コロイド標識抗体の展開が不充分なため結果が変化する恐れがありますので試料滴下後15分に満たない時間での判定は行わないで下さい。
(2)
試料滴下後15分経過したら速やかに判定を行って下さい。判定時間を過ぎたテストプレートは乾燥等により結果が変化する場合がありますので、判定には使用しないで下さい。
(3)
操作上の問題、あるいは試薬の品質上の問題により判定部[C]に赤紫色のラインが認められない場合があります。別のテストプレートで試験をやり直して下さい。やりなおしても同様の結果であれば、検体要因やだ液の影響により判定部[C]に赤紫色のラインが認められない場合がありますので、2倍希釈した試料で再検査をお試し下さい。
(4)
抗原量が非常に多い場合には、判定部[A]または[B]に非常に濃いラインが認められ、判定部[C]にラインが認められないことがあります。このような場合は試料を検体抽出液で11倍希釈して再検査して下さい。
例)試料の希釈方法:検体抽出液1mLに対して試料を3滴滴下し、充分に混和し試料とする。
例)試料の希釈方法:検体抽出液1mLに対して試料を3滴滴下し、充分に混和し試料とする。
(5)
検体要因で判定部の色抜けが遅れている場合あるいは判定部[T]ライン上で白く抜けた様に見える場合には、試料を滴下して15分後から更に5分程度判定時間を延ばすことによって現象が改善されることがあります。
性能
1.
性能用法及び用量欄の操作方法により陽性コントロール(インフルエンザAウイルス抗原の場合は3.0〜3.9×105TCID50/テスト注1、インフルエンザBウイルス抗原の場合は1.5〜1.9×106TCID50/テスト)、弱陽性コントロール(インフルエンザAウイルス抗原の場合は3.0〜3.9×104TCID50/テスト、インフルエンザBウイルス抗原の場合は1.5〜1.9×105TCID50/テスト)および陰性コントロール(検体抽出液)を用いて感度、正確性、同時再現性の各試験を行った場合、以下の規格に適合する。※
(注1)TCID50/テスト
試料の10nの希釈系列を作成し、MDCK(Madin Darby Canine Kidney)細胞に対する50%の細胞変性効果(CPE)が認められたときの希釈倍数を10nTCID50/テストのウイルス感染価とする。
(1)
感度陽性コントロールおよび弱陽性コントロールを試料として試験したとき、陽性が確認される。
(2)
正確性陽性コントロール、弱陽性コントロールおよび陰性コントロールを試料として試験したとき、陽性コントロールおよび弱陽性コントロールに対しては陽性、陰性コントロールに対しては陰性が確認される。
(3)
同時再現性陽性コントロール、弱陽性コントロールおよび陰性コントロールを試料として各3回同時に試験したとき、陽性コントロールおよび弱陽性コントロールに対しては全て陽性、陰性コントロールに対しては全て陰性が確認される。
2.
最小検出感度本品の最小検出感度は、インフルエンザAウイルス抗原の場合3.0×104TCID50/テスト、インフルエンザBウイルス抗原の場合1.5×105TCID50/テストである。
3.
交差反応性試験成績下記のウイルスおよび微生物との交差反応は認められなかった。
(1)
インフルエンザ以外のウイルスAdenovirus Type1〜7, 11, Coxsackie virus Type A9, 16, B1〜6, Cytomegalovirus, Echovirus Type 4, 6, 9, 11, 14, 16, Human Metapheumo virus, Influenza virus C, Measles virus, Parainfluenza virus Type1〜4, Respiratory syncytial virus, Rhinovirus Type2
(2)
細菌
Acinetobacter baumannii, Bacteroides fragilis, Candida albicans, Candida glabrata, Capnocytophega ochracea, Eikenella corrodens, Enterococcus gallinarum, Escherichia coli, Fusobacterium nucleatum, Haemophilus influenzae, Haemophilus parainfluenzae, Klebsiella pneumoniae, Legionella pneumophila, Listeria monocytogenes, Mycobacterium abscessus, Mycobacterium avium, Mycobacterium intracellulare, Mycobacterium Kansasii, Mycobacterium tuberculosis, Moraxella catarrhalis,Neisseria gonorrhoeae, Pasteurella multocida, Prevotella melaninogenica, Proteus mirabilis, Proteus vulgaris, Pseudomonas aeruginosa, Serratia marcescens, Staphylococcus aureus, Staphylococcus epidermidis, Streptococcus pneumoniae, Streptococcus pyogenes, Streptococcus agalactiae, Streptococcus groupC, G, F
4.
インフルエンザウイルス株との反応性
(1)
インフルエンザAウイルス亜型のH1N1:5株、H2N2:3株、H3N2:7株全てに反応が認められた。
(2)
インフルエンザBウイルスインフルエンザBウイルス9株全てに反応が認められた。
5.
インフルエンザウイルス亜型との反応性(北海道大学喜田らのデータ)以下の各株との反応が認められた。
(1)
ヒト由来 A型A/Puerto Rico/8/34(H1N1), A/Hokkaido/11/02(H1N1), A/Singapore/1/57(H2N2), A/Aichi/2/68(H3N2), A/Hokkaido/1/03(H3N2), A/Hong Kong/156/97(H5N1), A/Hong Kong/483/97(H5N1)
(2)
ヒト以外由来 A型A/duck/Czech/56(H4N6), A/duck/Pennsylvania/1028/83(H5N2), A/turkey/Massachusetts/3740/65(H6N2), A/seal/Massachusetts/1/80(H7N7), A/turkey/Ontario/67(H8N4), A/turkey/Wisconsin/66(H9N2), A/chicken/Germany/N/49(H10N7), A/duck/England/56(H11N6), A/duck/Alberta/60/76(H12N5), A/gull/Maryland/704/77(H13N6), A/mallard/Astrakhan/263/82(H14N5), A/duck/Australia/341/83(H15N8)
(3)
ヒト由来 B型B/Lee/40, B/Hokkaido/26/99
相関性試験成績
1.
自主点検試験結果成績(ウイルス分離培養法との比較)| 検体種 | 陽性一致率(%) | 陰性一致率(%) | 全体一致率(%) | 検体数 | ||
| (1) | 鼻腔ぬぐい液 | A型 | 96.4(54/56) | 94.3(116/123) | 95.0(170/179) | 179 |
| B型 | 83.8(31/37) | 100.0(142/142) | 96.6(173/179) | 179 | ||
| (2) | 鼻腔吸引液 | A型 | 92.9(169/182) | 97.3(676/695) | 96.4(845/877) | 877 |
| B型 | 86.9(153/176) | 99.6(698/701) | 97.0(851/877) | 877 | ||
| (3) | 咽頭ぬぐい液 | A型 | 78.0(32/41) | 94.7(36/38) | 86.1(68/79) | 79 |
| 検体採取・実施施設 | ウイルス分離培養実施施設 | |
| (1) | 3施設 | 大阪府立公衆衛生研究所 川崎市衛生研究所 |
| (2) | 3施設 | 大阪府立公衆衛生研究所 広島県保健環境センター |
| (3) | 10施設 | 原土井病院 |
2.
国内の臨床性能評価結果(既承認医薬品との比較)
(1)
鼻腔吸引液| 本品 | |||||
| A陽性 | B陽性 | 陰性 | 計 | ||
| 既承認医薬品 | A陽性 | 30 | 0 | 0 | 30 |
| B陽性 | 0 | 23 | 2注2 | 25 | |
| 陰性 | 1注2 | 0 | 28 | 29 | |
| 計 | 31 | 23 | 30 | 84 | |
B陽性一致率:92.0%(23/25)
陰 性一致率:96.6%(28/29)
全 体一致率:96.4%(81/84)
(注2)3検体はいずれもウイルス分離培養法陰性、RT-PCR法陰性
(2)
鼻腔ぬぐい液| 本品 | |||||
| A陽性 | B陽性 | 陰性 | 計 | ||
| 既承認医薬品 | A陽性 | 129 | 0 | 3 | 132 |
| B陽性 | 0 | 79 | 0 | 79 | |
| 陰性 | 2 | 0 | 94 | 96 | |
| 計 | 131 | 79 | 97 | 307 | |
B陽性一致率:100.0%(79/79)
陰 性一致率:97.9%(94/96)
全 体一致率:98.4%(302/307)
(3)
咽頭ぬぐい液| 本品 | |||||
| A陽性 | B陽性 | 陰性 | 計 | ||
| 既承認医薬品 | A陽性 | 29 | 0 | 0 | 29 |
| B陽性 | 0 | 29 | 0 | 29 | |
| 陰性 | 1 | 0 | 108 | 109 | |
| 計 | 30 | 29 | 108 | 167 | |
B陽性一致率:100.0%(29/29)
陰 性一致率:99.1%(108/109)
全 体一致率:99.4%(166/167)
使用上又は取扱い上の注意
取扱い上(危険防止)の注意
1.
検体抽出液が目などに入った場合には、直ちに多量の水で15分以上洗い流して下さい。異常があれば、医師の手当てを受けて下さい。
2.
検体抽出液が手や衣服についた場合には、付着部又は接触部を石鹸又は多量の水で十分に洗い流して下さい。
使用上の注意
1.
本品は、インフルエンザA型ウイルスおよびインフルエンザB型ウイルスに反応し、C型には反応しません。
2.
本品は、インフルエンザAウイルス抗原およびインフルエンザBウイルス抗原を迅速に検出するための試薬です。確定診断は、臨床症状やウイルスの分離培養等、他の検査結果と合わせて担当医師が総合的に判断して行って下さい。
3.
添付文書に記載された操作方法に従って使用して下さい。
4.
品質の低下を防ぐため、高温多湿および直射日光を避け、2〜30℃で保存して下さい。
5.
テストプレートの入ったアルミ袋は使用時まで開封しないで下さい。
6.
テストプレートの試料滴下部および判定部を直接手などで触れないで下さい。
7.
検体抽出液に沈殿が認められることがありますが、検査結果には影響を与えないことを確認しておりますので、そのままご使用下さい。
8.
付属の綿棒を使用する場合は、検体抽出後速やかに抜き取って下さい。長時間試料に浸したままにしておくと軸部が給水してしまいます。
9.
付属の綿棒は紙軸のため強く曲げたりすると折れる恐れがありますので取り扱いには注意して下さい。
10.
鼻腔からの検体採取時、綿棒に鼻汁が塊として多量についた場合は、ガーゼ等で軽く塊を取り除いて下さい。但し、綿球の表面に付着した粘膜表皮を検体としますので、強く拭き取ることは避けて下さい。
11.
使用期限を過ぎた試薬は使用しないで下さい。
廃棄上の注意
1.
測定に使用したテストプレートや滅菌綿棒、ノズル、ドロッパーチューブ、試料の残り等は、感染の可能性のあるものとして、必ずオートクレーブ処理(121℃、20分)するか、0.1%次亜塩素酸に1時間以上浸して処理して下さい。試薬および器具等を廃棄する場合には、廃棄物の処理及び清掃に関する法律、水質汚濁防止法等の規定に従って処理して下さい。
2.
検体抽出液には、防腐剤としてアジ化ナトリウムが0.09%含まれています。アジ化ナトリウムを含む液を長期間にわたって廃棄しますと、配水管が金属の場合爆発性の金属アジドを生成することがありますので廃棄する場合には多量の水と共に流して下さい。
貯蔵方法、有効期間
貯蔵方法
2〜30℃で保存
有効期間
21ヶ月
包装単位
キャピリアFlu A+B 10テスト用
キャピリアFlu A+B 100テスト用
| 構成試薬名 | 10テスト用 |
| テストプレート | 10個 |
| 検体抽出液(1mL) | 10本 |
| 付属品 滅菌綿棒 フィルター付ノズル | 11本 10個 |
| 構成試薬名 | 100テスト用 |
| テストプレート | 100個 |
| 検体抽出液(1mL) | 100本 |
| 付属品 滅菌綿棒 フィルター付ノズル | 110本 100個 |
製造販売業者の氏名又は名称及び住所
氏名又は名称(製造販売業の種別)
ロート製薬株式会社
第二種医薬品製造販売業
住所等
大阪府大阪市生野区巽西1-8-1
電話番号
06-6758-1230
問い合わせ先
氏名又は名称
アルフレッサ ファーマ株式会社
住所等
〒540-8575 大阪市中央区石町二丁目2番9号
電話番号
TEL:0120-0308-69 FAX:06-6941-4861